题目内容
19.下列叙述正确的是( )| A. | 在共价化合物中一定存在共价键 | |
| B. | 只存在共价键的物质一定是共价化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中只含有离子键 |
分析 共价化合物中原子间以共用电子对形成化学键,属于共价键,离子化合物中一定含有离子键,可能含有共价键,以此解答该题.
解答 解:A.共价化合物中不同原子间以共用电子对形成化学键,共价化合物中只含共价键,故A正确;
B.只存在共价键的物质可以是共价化合物或非金属单质,故B错误;
C.含有共价键的化合物不一定是共价化合物,为NaOH,含有共价键和离子键,为离子化合物,故C错误;
D.离子化合物中一定含有离子键,可能含有共价键,如NaOH,故D错误.
故选A.
点评 本题考查化学键及化合物的类别,为高频考点,熟悉化学键的形成及特殊物质中的化学键即可解答,注意利用实例来分析解答.

练习册系列答案
相关题目
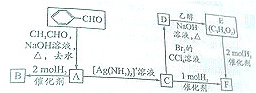
9.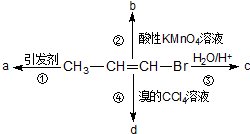 1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
 1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
7.足量的锌加入100mL18mol/L的浓硫酸中充分反应,则被还原的H2SO4的物质的量为( )
| A. | 1.8mol | B. | <0.9mol | ||
| C. | 0.9mol | D. | 在0.9mol和1.8mol之间 |
14.对于H3O+的下列说法中正确的是( )
| A. | O原子采用SP2杂化 | B. | O原子采用SP3杂化 | ||
| C. | 离子中不存在配位键 | D. | 离子中存在非极性键 |
4.下列排列顺序不正确的是( )
| A. | 非金属性:F>Cl>S | B. | 熔点:SiO2>KCl>I2 | ||
| C. | 稳定性:HF>H2S>H2O | D. | 碱性:KOH>NaOH>Al(OH)3 |
11.下列反应中原子利用率高,符合“绿色化学”要求,无污染环境因素的是( )
| A. | 乙烷与Cl2反应制氯乙烷 | B. | 乙醇和浓硫酸共热制乙烯 | ||
| C. | 乙酸和乙醇共热酯化 | D. | 乙烯与氧气在银催化作用下生成 |
8.下列各组物质最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | CH3CH═CH2和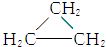 | B. | 乙炔和苯 | C. | 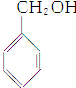 和 和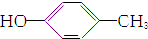 | D. | 乙酸和甲酸甲酯 |
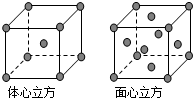 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.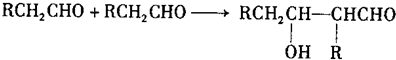
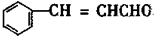 B
B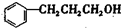 C
C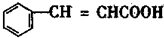 D
D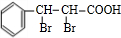
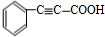 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$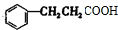 ;加成反应;.
;加成反应;.