题目内容
3.对于Zn与稀硫酸的反应,下列叙述不正确的是( )
| A. | 反应过程中能量关系可用如图表示: | |
| B. | 若将该反应设计成原电池,锌为负极 | |
| C. | 若将该反应设计成原电池,正极可用石墨 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出的气体一定为11.2 L |
分析 对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),反应为放热反应,则反应物的总能量大于生成物的总能量,当将该反应设计呈原电池时,Zn为负极,被氧化,正极为不如锌活泼的金属或者石墨上析出氢气,以此解答该题.
解答 解:A.反应为放热反应,则反应物的总能量大于生成物的总能量,图示正确,故A正确;
B.反应中Zn被氧化生成ZnSO4,当将该反应设计呈原电池时,Zn为负极,故B正确;
C.反应中Zn被氧化生成ZnSO4,当将该反应设计呈原电池时,Zn为负极,正极为不如锌活泼的金属或者石墨,故C正确;
D.若将其设计为原电池,当有32.5g锌溶解时,转移电子1mol,则正极放出气体的体积在标况下为11.2L,未指明标况下就不一定为11.2 L,故D错误.
故选D.
点评 本题考查化学反应能量的变化,题目难度不大,本题注意反应热以及原电池的工作原理,学习中注意相关知识的理解和掌握.

练习册系列答案
相关题目
13. 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法错误的是( )
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法错误的是( )
 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法错误的是( )
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法错误的是( )| A. | 该混合气体中一定含有乙烯 | |
| B. | 该混合气体中有且只有一种烷烃 | |
| C. | 组成该混合气体的烃分子所含氢原子数均为4 | |
| D. | 若混合气体由CH4和C2H4组成,则其体积比为2:3 |
14.对于H3O+的下列说法中正确的是( )
| A. | O原子采用SP2杂化 | B. | O原子采用SP3杂化 | ||
| C. | 离子中不存在配位键 | D. | 离子中存在非极性键 |
11.下列反应中原子利用率高,符合“绿色化学”要求,无污染环境因素的是( )
| A. | 乙烷与Cl2反应制氯乙烷 | B. | 乙醇和浓硫酸共热制乙烯 | ||
| C. | 乙酸和乙醇共热酯化 | D. | 乙烯与氧气在银催化作用下生成 |
18.一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,如由乙烯可制丙醛:
CH2═CH2+CO+H2$\stackrel{催化剂}{→}$CH3CH2CHO
由丙烯进行醛化反应也可得到醛,下列说法正确的是( )
CH2═CH2+CO+H2$\stackrel{催化剂}{→}$CH3CH2CHO
由丙烯进行醛化反应也可得到醛,下列说法正确的是( )
| A. | 能得到一种醛 | B. | 能得到二种醛 | ||
| C. | 能得到三种醛 | D. | 该反应为取代反应 |
8.下列各组物质最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | CH3CH═CH2和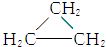 | B. | 乙炔和苯 | C. | 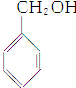 和 和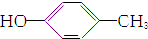 | D. | 乙酸和甲酸甲酯 |
12.绿色能源是指使用不会对环境造成污染的能源.下列属于绿色能源的是( )
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①②⑥ |
13.实验室在2L的密闭容器里加入0.1molCO和0.1molNO,在T℃进行反应,有关数据记录如表:
(1)0~10s内用N2表示该反应的平均反应速率为0.0015mol/(L•s);
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
| 时间/s | 5 | 10 | 15 | 20 | 25 |
| n(CO2)/mol | 0.04 | 0.06 | 0.07 | 0.08 | 0.08 |
(2)T℃下该反应的平衡常数(N2化学计量数为1)为3200.
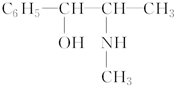
 ;
;