题目内容
12.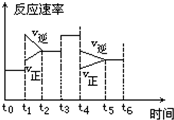 在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:
在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:回答下列问题:
(1)处于平衡状态的时间段是t0~t1,t2~t3,t3~t4,t5~t6.
(2)t1、t3、t4时刻体系中分别对应的条件变化为:升高温度,使用催化剂,减小压强;
(3)下列各时间段时,氨的百分含量最高的是A.
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)对于上述反应,起始时加入1mol N2和3mol H2,在恒温恒压条件下反应达到平衡时生成a mol NH3,在恒温恒容条件下,达到平衡时生成b mol NH3,则a和b的大小关系为a>b
(5)对于上述反应,在恒温恒容条件下,起始时充入2mol N2和3mol H2,达到平衡时生成b mol NH3,若相同条件下,起始时充入x mol N2,y mol H2,z mol NH3,达到平衡时混合物中各组分的百分含量不变,则x、y、z 取值必须满足的一般条件为:x+0.5z=2,y+1.5z=3;(一个只含x,z;另一个只含y,z)
分析 (1)从平衡状态的本质特征分析,可逆反应达到平衡时,正逆反应速率相等;
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t3正逆反应速率同等程度的增大;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;
(3)随着反应的进行,生成的氨气逐渐增多,氨气的体积分数逐渐增大;
(4)恒压条件下反应,与恒容条件相比,恒压下的压强大于恒容时的压强,平衡向着正向移动;
(5)依据极值转化为起始量,满足“等量等效”分析.
解答 解:(1)从平衡状态的本质特征分析,可逆反应达到平衡时,正逆反应速率相等,时间处于t0~t1,t2~t3,t3~t4,t5~t6时,正逆反应速率相等,则说明反应达到平衡状态,故答案为:t0~t1,t2~t3,t3~t4,t5~t6;
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:升高温度;使用催化剂;减小压强;
(3)随着反应的进行,生成的氨气逐渐增多,氨气的体积分数逐渐增大,反应进行到最大时间时,生成的氨气最多,氨的体积分数最高,故答案为:A;
(4)由于该反应是体积减小的反应,恒压时的压强大于恒容条件下的压强,压强增大,平衡向着正向移动,所以a>b,故答案为:a>b;
(5)N2(g)+3H2(g)?2NH3(g)
起始量 2 3 0
起始量 x y z
转化量 x+0.5z y+1.5z 0
XYZ满足关系为:x+0.5z=2,y+1.5z=3
故答案为:x+0.5z=2;y+1.5z=3.
点评 本题考查化学反应速率的变化曲线以及等效平衡,掌握恒温、恒容下前后气体体积不等的可逆反应等效平衡的条件时解题的关键,题目难度中等,注意化学方程式的特点,判断温度、压强对反应平衡移动的影响,结合外界条件对反应速率的影响分析.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案[Cu(H2O)4]2+(淡蓝色)+4Cl-?[CuCl4]2-(黄绿色)+4H2O,下列方法能使溶液变成淡蓝色的是( )
| A. | 加压 | B. | 加入NaCl溶液 | C. | 加AgNO3溶液 | D. | 加盐酸 |
| A. | 加入适量的6mol/L的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入适量醋酸钠溶液 | D. | 加入适量的硝酸钾溶液 |
| A. | 硫酸钠(aq) | B. | 硝酸钾(aq) | C. | 醋酸钠(s) | D. | 水 |
[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
(蓝) (绿)
能使黄绿色CuCl2溶液向蓝色转化的操作是( )
| A. | 蒸发浓缩 | B. | 加水稀释 | C. | 加入AgNO3 | D. | 加入食盐晶体 |
①O2 ②S ③HCl ④CuCl2 ⑤HNO3 ⑥溴 ⑦H2O.
| A. | ①②⑤ | B. | ①⑥ | C. | ①⑤⑥⑦ | D. | ①⑤⑥ |