题目内容
20.100mL浓度为2mol/L的盐酸跟略过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )| A. | 加入适量的6mol/L的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入适量醋酸钠溶液 | D. | 加入适量的硝酸钾溶液 |
分析 过量的锌片,盐酸完全反应,则减慢反应速率又不影响生成氢气的总量,可减小氢离子浓度或减小金属的接触面积等,不改变其氢离子物质的量即可,注意原电池反应可增大反应速率,以此来解答.
解答 解:A.加入适量的6 mol•L-1的盐酸,反应速率加快,生成氢气增多,故A不选;
B.加入数滴氯化铜溶液,锌置换出铜形成原电池反应,反应速率增大,故B不选;
C.加入适量醋酸钠溶液,生成醋酸,因醋酸为弱酸,浓度减小,反应速率减小,生成氢气的总量不变,故C选;
D.加入适量的硝酸钾溶液,由于硝酸根离子在酸性条件下具有强氧化性,反应生成NO气体,故D不选.
故选C.
点评 本题考查影响化学反应速率的因素,注意把握浓度、接触面积对反应速率的影响即可解答,注重基础知识的考查,注意Zn过量盐酸完全反应,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
10.下列说法错误的是( )
| A. | 氯气的摩尔质量是71 g/mol | |
| B. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| C. | 酸性的雨水都是酸雨,酸雨的PH小于7 | |
| D. | 1mol CO2的质量是44 g |
11.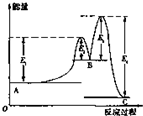 某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量变化曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | A→C的反应为吸热反应 | B. | 三种物质中B最不稳定 | ||
| C. | 加入催化剂,E1、E2、E3、E4均不变 | D. | A→C反应的△H=E1-E2 |
5.将8g NaOH固体溶于水配成250mL溶液,从中取出50mL,则这50mL NaOH溶液的物质的量浓度为( )
| A. | 0.16 mol•L-1 | B. | 4mol•L-1 | C. | 0.8 mol•L-1 | D. | 8 mol•L-1 |
9.某烷烃的结构简式为: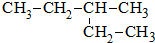 其系统命名正确的是( )
其系统命名正确的是( )
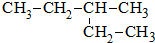 其系统命名正确的是( )
其系统命名正确的是( )| A. | 2-乙基丁烷 | B. | 3-乙基丁烷 | C. | 3-甲基丁烷 | D. | 3-甲基戊烷 |
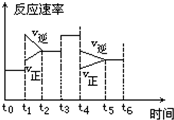 在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:
在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图: