题目内容
1.能量对人类社会的发展有着至关重要的作用,在化学反应中能量以多种形式表现出来.(1)中和热
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:
①中学化学实验中的中和热的测定所需的玻璃仪器有:大小烧杯、量筒、温度计、胶头滴管、环形玻璃搅拌棒,在大小烧杯之间填满碎泡沫(或纸条)其作用是保温、隔热、减少实验过程中热量的损失.
②该实验常用0.50mol•L-1 HCl和0.55mol•L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是保证盐酸完全被中和.
③若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g•℃),反应前后溶液的温度升高3.4℃,则△H=-56.8kJ/mol.
(2)化学在能源开发中起着十分关键的作用.
①蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体.甲烷气体燃烧和水汽化的热化学方程式分别为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ•mol-1,H2O(l)═H2O(g)△H=+44kJ•mol-1;则“可燃冰”释放的32g甲烷气体完全燃烧生成液态水,放出的热量为1780.6kJ_.
②0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ•mol-1
③用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJ•mol-1.
分析 (1)①根据量热计的构造和实验步骤来确定实验的仪器;中和热测定实验成败的关键是保温工作;
②为了保证HCl完全反应,碱应过量;
③根据Q=c•m•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(2)①先根据盖斯定律求出甲烷燃烧热的热方程式,再根据燃烧热计算;
②0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,据此书写热化学反应方程式;
③先写出反应的化学方程式,即2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g),然后利用盖斯定律解答;
解答 解:(1)中和热测定的实验中,用到的玻璃仪器有大烧杯、小烧杯、温度计、量筒、胶头滴管,环形玻璃搅拌棒;大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失;
故答案为:温度计、胶头滴管;环形玻璃搅拌棒;保温、隔热、减少实验过程中热量的损失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和,故答案为:保证盐酸完全被中和;
(3)50mL0.55mol•L-1NaOH溶液与50mL0.50mol•L-1 HCl溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为:Q=c•m•△T=4.18J/(g•℃)×100g×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-$\frac{1.4212kJ}{0.025mol}$=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(2)①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ•mol-1 ①
H2O(l)═H2O(g)△H=+44kJ•mol-1 ②
根据盖斯定律,由①-②×2得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol;
甲烷的燃烧热为890.3 kJ/mol,则“可燃冰”释放的32g即2mol甲烷气体完全燃烧生成液态水,放出热量890.3kJ/mol×2mol=1780.6kJ;
故答案为:1780.6kJ;
②0.3molB2H6气体在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,则1molB2H6完全反应放出2165 kJ热量,则该热化学反应方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ•mol-1 ,故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165 kJ•mol-1;
③利用盖斯定律进行计算,将三个方程式进行形式变换,
CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1 ①
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1 ②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1 ③
根据盖斯定律,由①×2+②-③×2得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJ•mol-1
故答案:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJ•mol-1.
点评 本题主要考查学生有关中和热的测定、热化学方程式的书写、盖斯定律的运用等问题,侧重热化学方程式书写及盖斯定律应用的考查,难度不大.

| A. | 铁、铝的都属于轻金属 | |
| B. | 生铁的硬度和熔点都比纯铁高 | |
| C. | 铁、铝的单质都具有银白色金属光泽,都属于有色金属 | |
| D. | 金属形成合金后通常具有更多优良性能,所以用途更广泛 |
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.1Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | △H2>△H3 | D. | △H2<△H3 |
| A. | 1种 | B. | 2种 | C. | 4种 | D. | 16种 |
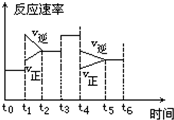 在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:
在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图: