题目内容
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
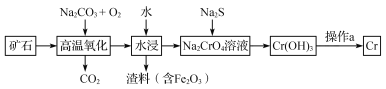
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
③操作a由两种均发生了化学反应的过程构成的,其内容分别是_______________、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式____________________________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸 (H2CrO4) 溶液中各种含铬元素的微粒浓度分别为:c(![]() )=0.0005 mol·L1、c(
)=0.0005 mol·L1、c(![]() )=0.1035 mol·L1、c(
)=0.1035 mol·L1、c(![]() )=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
)=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有![]() 的污水方法通常为:用铁作电极电解污水,
的污水方法通常为:用铁作电极电解污水,![]() 被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol
被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol ![]() 的污水,则至少需要消耗的铁为_______g。
的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含![]() 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出![]() 在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol
在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol![]() (不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
(不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
【答案】(1) ①+3 (1分) ②4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2(2分) ③灼烧使 Cr(OH)3分解 (或其它合理说法,1分)
2Fe2O3+8Na2CrO4+8CO2(2分) ③灼烧使 Cr(OH)3分解 (或其它合理说法,1分)
(2)NaCrO2、Cr2(SO4)3(2分)
(3)0.448(1分) <(1分)
(4)①2H2O+2e![]() 2OH+H2 ↑(或者2H++2e
2OH+H2 ↑(或者2H++2e![]() H2↑)(1分) 3360(2分)
H2↑)(1分) 3360(2分)
②3Fe2++![]() +8H+
+8H+![]() 3Fe3++Cr3++4H2O(2分) Cr2Fe20O27(2分)
3Fe3++Cr3++4H2O(2分) Cr2Fe20O27(2分)
【解析】(1) ①Fe(CrO2)2中各元素化合价均为整数,若Fe的化合价为+3,则Cr的化合价为+![]() ,不为整数,若Fe的化合价为+2,则Cr的化合价为+3,为整数,符合题意。 ②由流程图知,高温氧化时的生成物有Fe2O3、Na2CrO4、CO2,由此可写出:Fe(CrO2)2+O2+Na2CO3→Fe2O3+Na2CrO4+CO2,配平即可。③铝热反应是单质铝与难熔金属氧化物之间的反应,故另一种变化是灼烧使Cr(OH)3分解成Cr2O3。
,不为整数,若Fe的化合价为+2,则Cr的化合价为+3,为整数,符合题意。 ②由流程图知,高温氧化时的生成物有Fe2O3、Na2CrO4、CO2,由此可写出:Fe(CrO2)2+O2+Na2CO3→Fe2O3+Na2CrO4+CO2,配平即可。③铝热反应是单质铝与难熔金属氧化物之间的反应,故另一种变化是灼烧使Cr(OH)3分解成Cr2O3。
(2)可根据Al(OH)3与NaOH、硫酸反应的情况进行类比。
(3)由于溶液中没有H2CrO4分子,故H2CrO4是强酸,根据铬元素守恒可求出a=0.448。KHCrO4溶液中,![]() 能电离但不能水解,故溶液显酸性,c(OH-)<c(H+)。
能电离但不能水解,故溶液显酸性,c(OH-)<c(H+)。
(4)① 阴极上是H+得到电子生成氢气,阳极上是单质铁失去电子转化为Fe2+,然后Fe2+将![]() 还原为Cr3+,本身则被氧化为Fe3+,依得失电子守恒原理知还原10 mol
还原为Cr3+,本身则被氧化为Fe3+,依得失电子守恒原理知还原10 mol ![]() ,需要消耗60 mol Fe2+,故阳极上溶解的铁为60 mol,质量为3360 g。②由题给条件知
,需要消耗60 mol Fe2+,故阳极上溶解的铁为60 mol,质量为3360 g。②由题给条件知![]() 被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式为3Fe2++
被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式为3Fe2++![]() +8H+
+8H+![]() 3Fe3++Cr3++4H2O。由铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2及加入的亚铁盐总量为10 mol知,磁性铁铬氧体中n(Fe2+)=6 mol、n(Fe3+)=4 mol,n(Cr3+)= 1 mol,依化合价规则,2z=1
3Fe3++Cr3++4H2O。由铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2及加入的亚铁盐总量为10 mol知,磁性铁铬氧体中n(Fe2+)=6 mol、n(Fe3+)=4 mol,n(Cr3+)= 1 mol,依化合价规则,2z=1![]() 3+6
3+6![]() 2+3
2+3![]() 4,z=13.5,故磁性铁铬氧体的化学式为Cr2Fe20O27。
4,z=13.5,故磁性铁铬氧体的化学式为Cr2Fe20O27。

 考前必练系列答案
考前必练系列答案【题目】归纳整理是科学学习的重要方法之一。氧族元素的部分性质归纳整理如下:
|
|
|
|
|
单质熔点/℃ | -218,4 | 113 | ? | 450 |
单质沸点/℃ | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
请根据上表数据以及数据变化趋势,回答下列问题:
(1)硒的熔点范围可能是:________________;
(2)碲(Te)可能的化合价有:___________________;
(3)硒(Se)的原子半径可能在_______________________之间。
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐_________(增强、减弱)。
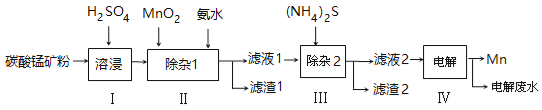
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)






