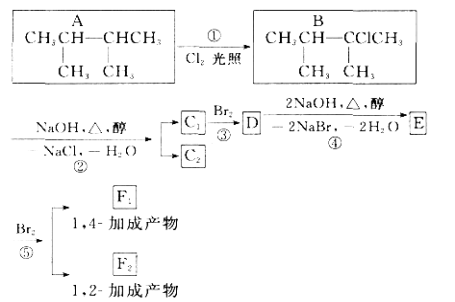
题目内容
【题目】溴乙烷是一种重要的液体化工原料,沸点38.4 ℃,难溶于水且为非电解质,可与碱溶液反应。实验室中可利用如下原理制取少量溴乙烷:
H2SO4(浓)+NaBr+C2H5OH→C2H5Br+NaHSO4。
某研究性学习小组的同学设计了如图所示的装置(支持及加热仪器已省略)来制备溴乙烷,并验证有副产物SO2、CO2、C2H4生成(SO2沸点10 ℃)。

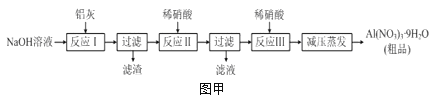
(1)仪器B的名称是________,装置D用来检验并除去乙烯,则D中的试剂是________,F的用途是_____________________________________________________,证明一定有CO2生成的现象是__________________________________。
(2)C中所得到的溴乙烷中含有少量的乙醇、Br2、HBr。为得到纯净的溴乙烷,该同学取出C中的液体依次用水洗→___________洗→水洗,再用__________干燥,最后进行蒸馏。洗涤实验中,所用的玻璃仪器除烧杯外还一定需要的仪器名称是__________。
(3)假设上述实验都得到了预期的实验现象,写出乙醇与浓硫酸反应生成上述无机气体时的化学方程式:___________________________________。
(4)小组的同学对产品有存在溴单质的原因及验证方法进行了分析讨论。
①含有溴单质的依据是__________________________________。
②请设计一种实验方案,利用化学方法证明C中的液体中含有单质溴:_________________________________________________________________。
【答案】(1)直形冷凝管(1分) 溴的CCl4溶液(1分) 除去SO2(1分) F的颜色没有全褪去而G中出现浑浊(2分,若只答出“G中有白色沉淀生成”得1分)
(2) Na2CO3溶液(或NaHCO3溶液、Na2SO3溶液)(1分) 无水CaCl2(或无水Na2SO4)(1分) 分液漏斗(1分)
(3)C2H5OH+6H2SO4(浓)![]() 2CO2↑+6SO2↑+9H2O (2分)
2CO2↑+6SO2↑+9H2O (2分)
(4)浓硫酸有强氧化性,可氧化1价的溴(2分,答案合理即给分) 取适量的C中液体与适量含CCl4的KI溶液混合,充分振荡后静置,有机层中显紫色(2分,答案合理即给分)
【解析】(1)溴水、溴的CCl4溶液、酸性KMnO4溶液均可检验乙烯,但因SO2也可被溴水、酸性KMnO4溶液氧化,故应该使用溴的CCl4溶液检验乙烯,用品红溶液检验SO2,用酸性KMnO4溶液除去SO2,由于SO2遇澄清的石灰水也能生成白色沉淀,故证明有CO2生成的现象是F中溶液颜色没有全褪去而G中有白色沉淀生成。
(2)可采取向混合物中加入Na2CO3溶液或NaHCO3溶液或Na2SO3溶液的方法除去用水无法除净的Br2,用无水CaCl2或Na2SO4等干燥剂除去残留的水。
(3)可先写出C2H5OH+H2SO4(浓)→CO2+SO2,依得失电子守恒得C2H5OH+6H2SO4(浓)→2CO2↑+6SO2↑,最后由质量守恒可确定最后的结果。
(4)浓硫酸有强氧化性,可将1价溴氧化。可利用溴单质的强氧化性,用KI或FeBr2+KSCN溶液等试剂检验。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】含氮化合物是化学与工业中运用广泛的物质。

(1)该小组利用电解原理设计了如右图装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极)。铂电极B是____极,钯电极A的电极反应式为_____________。
(2)若工业废水中的NO2- 的浓度约为1.0×10-4 mol·L-1 ,取工业废水5 mL 于试管中,滴加2滴0.1 mol·L-1 的硝酸银溶液,能否看到沉淀现象?试通过计算说明。(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol。请计算热化学方程式2H2(g) + S2(g) = 2H2S(g)的ΔH=___________
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

根据图中信息,如何说明水解反应速率随温度升高而增大:_____________________。