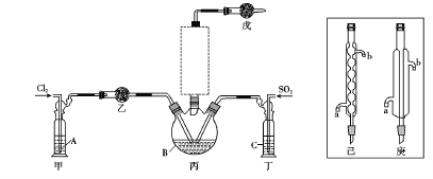
题目内容
【题目】下列是制备NH4NO3和Na2S2O4的一种工艺流程:(已知HNO2为弱酸)

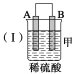
(1)装置Ⅰ的作用为 ,写出该装置中反应的离子方程式 。
(2)若装置Ⅱ中产生的硝酸根和亚硝酸根的物质的量比为1∶1,写出反应的离子方程式_______;区别硝酸钠和亚硝酸钠晶体的方法是(写一种)______。
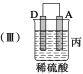
(3)装置Ⅳ中不通入氧气会产生的后果是________。
(4)若起始时通入等物质的量的NO和SO2,则通入n(NH3)∶ n(O2)=_________(假设过步骤中均完全转化)。
【答案】
(1)吸收SO2,分离NO和SO2 (2分) SO2+OH–= HSO3–(2分)
(2)2NO+3H2O+4Ce4+===NO3–+ NO2–+4 Ce3++6H+(2分)
测硝酸钠和亚硝酸钠晶体水溶液的pH(2分)
(3)会产生亚硝酸铵杂质(2分)
(4)2:1(2分)
【解析】
试题分析:
(1)由流程可知,二氧化硫被吸收;二氧化硫与氢氧化钠反应生成HSO3–;
(2)NO的产物NO3–、 NO2–,同时得到Ce3+,配平可得方程式;亚硝酸为弱酸,其盐水解溶液为碱性,据此可以区别;
(3)氧气的作用是把NO2–氧化为NO3–,不足或不通入会产生NH4NO2杂质;
(4)假设NO和SO2分别为1mol,根据元素守恒n(NH3)= n(NO3–)= n(NO)=1mol
根据电子守恒:3n(NO)= n(SO2)+ 4n(O2) n(O2)=0.5mol
n(NH3): n(O2)=1∶0.5=2∶1

练习册系列答案
相关题目