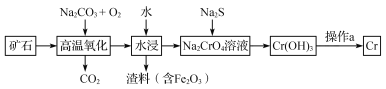
题目内容
【题目】硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取: SO2(g)+Cl2(g)![]() SO2Cl2(g) △H
SO2Cl2(g) △H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H1=﹣aKJ·mol﹣1
2SOCl2(g) △H1=﹣aKJ·mol﹣1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=﹣bKJ·mol﹣1
则△H= _______ kJ·mol﹣1(用含 a、b 的代数式表示,a>b>0)
(2)若在催化剂作用下,将nmol SO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L.
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=_______ mol/min。
②此温度下,该反应的K=________ L/mol。
③相同条件下,若将0.5nmolSO2与 0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_______.
(3)该反应的产物 SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式______。
【答案】(1)﹣(a﹣b) (2)①![]() ②
②![]() ③0.2nmol
③0.2nmol
(3)SO2Cl2+2H2O=H2SO4+2HCl
【解析】
试题分析:(1)①SO2(g)+Cl2(g)+SCl2(g)2SOCl2(g)△H1=-aKJmol-1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=-bKJmol-1
盖斯定律计算①-②得到:SO2(g)+Cl2(g)SO2Cl2(g)△H=-(a-b)KJ/mol;
(2)若在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L,设反应的二氧化硫物质的量为x,
SO2(g)+Cl2(g)SO2Cl2(g)
起始量(mol) n n 0
变化量(mol) x x x
平衡量(mol)n-x n-x x
保持温度为T,压强为P,气体体积之比等于气体物质的量之比,2n:(2n-x)=10:8,x=0.4n,
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=![]() mol/min;②依据①结合平衡概念计算,K═
mol/min;②依据①结合平衡概念计算,K═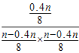 =
=![]() L/mol;③将nmolSO2与nmolCl2充入容积可变的密闭容器中,得到SO2Cl2,0.4nmol,则恒压容器中成正比例关系,相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,消耗二氧化硫物质的量为0.2n,混合物中SO2Cl2的物质的量是0.2nmol;
L/mol;③将nmolSO2与nmolCl2充入容积可变的密闭容器中,得到SO2Cl2,0.4nmol,则恒压容器中成正比例关系,相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,消耗二氧化硫物质的量为0.2n,混合物中SO2Cl2的物质的量是0.2nmol;
(3)SO2Cl2遇水发生剧烈水解,生成HCl和H2SO4,反应方程式SO2Cl2+2H2O=H2SO4+2HCl。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案