题目内容
5.氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越、安全性高、价格低廉、环保的储氢材料则成为氢能研究的关键.目前正在研究好已经使用的储氢合金有镁系合金、稀土系合金等.回答下列问题.(1)工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.该过程的主要能量转换形式为电能转化成化学能,氯化镁晶体脱水时工业冶炼镁的关键工艺之一先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;
(2)镁铝合金(Mg17Al12 )是一种潜在的储氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是防止Mg Al被空气氧化.
②在足量的HCl溶液中,混合物X能完全释放出H2.1molMg17Al12完全吸氢后得到的混合物X与上述盐酸完全反应,释放出H2的物质的量为52mol.
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现储氢和加氢:
 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$ (g)
(g) 一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).
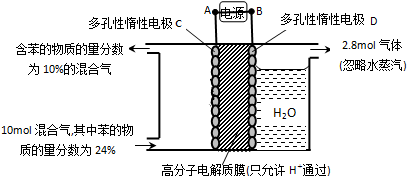
①A为电源的负极;C电极的电极反应式为C6H6+6H++6e-=C6H12.
②该储氢装置的电流效率η=64.3%.(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%,计算结果保留小数点后1位).Fe3O4/Al2O3.
分析 (1)根据氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能;电解主要是将电能转化成化学能;先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;
(2)①镁、铝是亲氧元素,易被氧气氧化;
②释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(3)①根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,D作阳极,所以A是负极、B是正极;
②阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率.
解答 解:(1)因为氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能,所以用电解无水氯化镁而不是氧化镁获得镁;电解主要是将电能转化成化学能;MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;故答案为:消耗大量的电能;电能转化成化学能;MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;
(2)①镁、铝都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化,故答案为:防止Mg Al被空气氧化;
②1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,故答案为:52mol;
(3)①根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,D作阳极,所以A是负极、B是正极,故答案为:负极;C6H6+6H++6e-=C6H12;
②阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,
生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量=$\frac{10mol×24%-x}{10mol-3xmol+5.6mol}$=10%,
x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则$\frac{7.2mol}{11.2mol}$×100%=64.3%,故答案为:64.3%.
点评 本题考查较综合,涉及常见金属元素及其化合物主要性质、氧化还原反应的计算、化学平衡计算、电化学原理等,把握化学反应原理为解答的关键,侧重分析、应用能力的考查,题目难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案| A. | KNO3只发生氧化反应 | B. | 反应消耗12g C时电子转移5mol | ||
| C. | 还原产物只有K2S和 N2 | D. | 被氧化与被还原的S为1:3 |
| A. | 常温常压下,32g O2和16g O3的混合物中,含有O原子数目为2NA | |
| B. | 标准状况下,1mol Na2O 和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为 $\frac{2}{3}$NA |
| A. | 使用LED照明灯属于“低碳生活”方式 | |
| B. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被侵蚀 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3) | |
| D. | 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
| A. | 卤代烃消除 | B. | 煤高温干馏 | C. | 炔烃加成 | D. | 石油裂解 |
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4 (用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe 2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.

①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成.
③常温下,若电解1L0.1mol•L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为0.01mol.
④写出过量的E与F溶液中溶质反应的离子方程式AlO2-+4H+=Al3++2H2O.
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
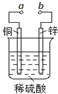
| A. | 当a和b用导线连接时,溶液中的SO42-向铜片附近移动 | |
| B. | 将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 | |
| C. | 当a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑ | |
| D. | a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
 .
.