题目内容
20.化学与日常生活密切相关,下列有关说法错误的是( )| A. | 使用LED照明灯属于“低碳生活”方式 | |
| B. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被侵蚀 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3) | |
| D. | 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 |
分析 A.LED照明灯发光效率高;
B.作原电池正极的金属被保护;
C.石灰乳为氢氧化钙,氢氧化钙呈碱性;
D.高性能的耐磨轮胎,可减少细颗粒物的产生.
解答 解:A.LED照明灯发光效率高,可节能,故A正确;
B.镁、不锈钢和电解质溶液构成原电池,镁易失电子作负极,不锈钢为正极,正极金属被保护,故B正确;
C.氢氧化钙为碱,盐碱地中碳酸钠溶液呈碱性,氢氧化钙和碳酸钠反应生成氢氧化钠,导致盐碱地碱性增强,故C错误;
D.高性能的耐磨轮胎,可减少细颗粒物的产生,减少空气污染,故D正确.
故选C.
点评 本题考查化学与生活,涉及节能减排、原电池、环境污染等,难度不大,注意盐碱地的成因.

练习册系列答案
相关题目
6.有机物M的结构简式如图所示,下列说法正确的是( )


| A. | 分子式为C17H18O3 | |
| B. | M中有4个饱和碳原子 | |
| C. | M可以使溴水和酸性高锰酸钾溶液褪色,但它们的反应类型不同 | |
| D. | 1mol M常温下最多可以与6 mol H2反应 |
7.下列分离方法中,和物质的溶解度无关的是( )
| A. | 萃取 | B. | 纸上层析 | C. | 过滤 | D. | 蒸馏 |
8.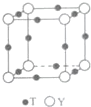 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.
(1)Y原子核外共有7种不同运动状态的电子,T原子的价层电子排列式3d104s1.
(2)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp.
(3)Z 与R能形成化合物甲,1mol甲中含4mol共价键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形、V形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++2 NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
(6)T与Y形成的晶体的晶胞结构如图所示,Y离子的配位数是6..设晶胞棱长为acm,密度为 bg•cm-3,则阿伏伽德罗常数可表示为$\frac{206}{b{a}^{3}}$(用含a、b的式子表示)
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,且最外层只有一个电子.(1)Y原子核外共有7种不同运动状态的电子,T原子的价层电子排列式3d104s1.
(2)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp.
(3)Z 与R能形成化合物甲,1mol甲中含4mol共价键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形、V形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)T与Y形成的晶体的晶胞结构如图所示,Y离子的配位数是6..设晶胞棱长为acm,密度为 bg•cm-3,则阿伏伽德罗常数可表示为$\frac{206}{b{a}^{3}}$(用含a、b的式子表示)
15.下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
| A. | C5H10和C6H6 | B. | C2H6和C2H4O2 | C. | C3H6和C3H8 | D. | C2H6和C3H8 |
9.用如图所示的实验装置完成对应的实验(部分仪器已省略),不能达到实验目的是( )
| A. |  制取纯净氢氧化亚铁 | B. | 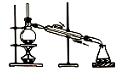 石油的蒸馏 | ||
| C. | 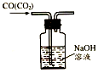 除去CO气体中的CO2气体 | D. | 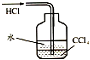 吸收HCl |
 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$ (g)
(g) 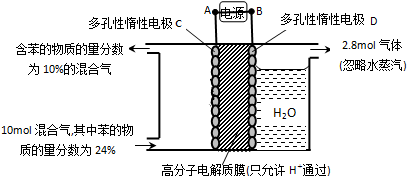
 A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.
A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.