题目内容
11.用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻愈小,它的电导愈大),如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大;若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度.现要兼顾吸收容量与灵敏度,测定空气中Cl2的含量,则应选用下列吸收剂中的 ( )| A. | Na2SO3溶液 | B. | KI溶液 | C. | NaOH溶液 | D. | H2O |
分析 根据题中信息:H2S+CuSO4=CuS↓+H2SO4,CuSO4溶液中离子浓度几乎不变,导电能力不变,电导变化不大,而H2S+Br2=2HBr+S↓,生成了强电解质HBr,溴水中离子浓度增大,导电能力增强,电导变化大,灵敏度高;可见溶液离子浓度增大,电导增大,测定时灵敏度高,A、B、C项溶液反应方程式:Na2SO3+Cl2+H2O=Na2SO4+2HCl,2KI+Cl2=2KCl+I2,2NaOH+Cl2=NaCl+NaClO+H2O,只有A项中溶液与Cl2反应使溶液中离子浓度增大,电导变化大,灵敏度高.
解答 解:根据题中信息:H2S+CuSO4=CuS↓+H2SO4,CuSO4溶液中离子浓度几乎不变,导电能力不变,电导变化不大,而H2S+Br2=2HBr+S↓,生成了强电解质HBr,溴水中离子浓度增大,导电能力增强,电导变化大,灵敏度高,可见溶液离子浓度增大,电导增大,测定时灵敏度高,测定空气中Cl2含量时,Cl2必须易溶于(因反应)该溶液;
A、亚硫酸钠和氯气反应,Na2SO3+Cl2+H2O=Na2SO4+2HCl,反应后溶液中离子浓度增大,电导变化大,灵敏度高,故A正确;
B、碘化钾溶液可以稀释氯气,反应为2KI+Cl2=2KCl+I2,反应前后离子浓度变化不大,电导变化不大,灵敏度不高,故B错误;
C、氢氧化钠溶液吸收氯气,发生反应2NaOH+Cl2=NaCl+NaClO+H2O,溶液与Cl2反应溶液中离子浓度变化不大,电导变化不大,灵敏度不高,故C错误;
D、氯气在水中溶解度不大,所以水的吸收能力很小,电导变化不大,灵敏度不高,故D错误;
故选A.
点评 本题考查了氯气性质的分析应用,主要是题干信息的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
1.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 1mol苯中碳碳双键的个数为3 NA | |
| B. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| C. | 0.1mol/L的FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 在标准状况下,2.24 L NO和1.12 L O2混合后的原子总数为0.3 NA |
2.4p能级只填充一半电子的原子,其原子序数是( )
| A. | 15 | B. | 33 | C. | 35 | D. | 51 |
19.下列叙述不正确的是( )
| A. | H2S、H2O、HF的稳定性依次增强 | |
| B. | RbOH、KOH、Ca(OH)2的碱性依次减弱 | |
| C. | Na+、Mg2+、Al3+的半径依次增大 | |
| D. | H3SiO3、H2CO3、H2SO4的酸性依次增强 |
16.
| 苯 | 甲苯 | 乙醇 | 乙烯 | 甲醛 | 苯酚溶液 | |
| 加入饱和溴水,振荡 | 上层变橙红色,下层无色 | 上层变橙红色,下层无色 | 无明显变化 | 褪色 | 褪色 | 白色沉淀 |
| 加入高锰酸钾酸性溶液,振荡 | 溶液分层,上层无色 | 褪色 | 褪色 | 褪色 | 褪色 | 褪色 |
| 新制的Cu(OH)2 | 分层,上层无色 | 分层,上层无色 | 无明显变化 | 红色沉淀 | ||
| 加入一小粒金属钠 | 钠沉到底部,不反应 | 钠沉到底部,不反应 | 放出气体 |
3.Cyrneine A对治疗神经系统疾病有着很好的疗效,其可以用香芹酮经过多步反应合成:

则下列有关的说法正确的是( )

则下列有关的说法正确的是( )
| A. | 香芹酮化学式为C9H12O,其一氯代物有12种 | |
| B. | 香芹酮分子中有8种不同化学环境的氢 | |
| C. | Cyrneine A可以发生加成反应、氧化反应、酯化反应等,但不能发生消去反应 | |
| D. | 香芹酮和Cyrneine A均能够使溴水和酸性KMnO4溶液褪色 |
20.下列有关FeBr2溶液的叙述错误的是( )
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO42-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
1.元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A. | 第1列中的碱金属和第17列元素的单质熔、沸点变化趋势相同 | |
| B. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| C. | 在整个18列元素中,第14列元素形成的化合物种类最多 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
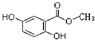 所示.
所示.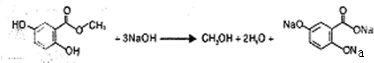 .(不用写反应条件)
.(不用写反应条件) .
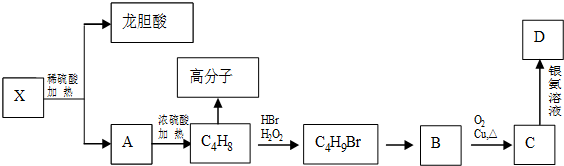
.
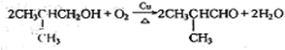 ,它的反应类型是氧化反应反应.
,它的反应类型是氧化反应反应.