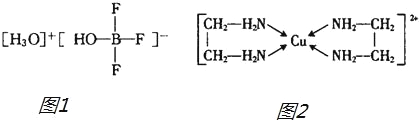题目内容
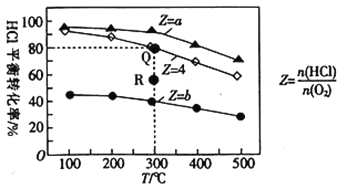
【题目】有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
容器 | 起始时 | ||
T/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300℃时,该反应平衡常数的值为320
【答案】D
【解析】A、由图象可知,随着温度的升高HCl的平衡转化率在减小,即升温平衡向左移动,则该反应是放热反应,△H<0,所以A正确;B、在相同温度时,n(HCl)相同,Z=a时HCl的转化率大于Z=4时HCl的转化率,即Ⅰ容器中增大了n(O2),使Z<4,即a<4,同理可得4<b,所以B正确;C、容器Ⅲ 即Z=4时,反应某时刻处于R点,即HCl的转化率小于平衡时HCl的转化率,则反应向正向进行,即v(正)>v(逆),所以C正确;D、由于平衡常数K只与温度有关,因此可根据容器Ⅲ对应的Q点进行计算,4HCl(g)+O2(g)![]() 2Cl2(g)+ 2H2O(g)平衡时HCl的转化率为80%,则起始时c(HCl)=0.5mol/L,由Z=4求得c(O2)= 0.125mol/L,而c(Cl2) =c(H2O)=0,平衡时c(HCl)=0.1mol/L ,c(O2)=0.025mol/L,c(Cl2) =c(H2O)=0.2 mol/L,则K=
2Cl2(g)+ 2H2O(g)平衡时HCl的转化率为80%,则起始时c(HCl)=0.5mol/L,由Z=4求得c(O2)= 0.125mol/L,而c(Cl2) =c(H2O)=0,平衡时c(HCl)=0.1mol/L ,c(O2)=0.025mol/L,c(Cl2) =c(H2O)=0.2 mol/L,则K=![]() =640 (mol/L)-1,所以D错误。本题正确答案为D。
=640 (mol/L)-1,所以D错误。本题正确答案为D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】镓与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态Ga原子的核外电子排布式为__________,基态As原子核外有__________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__________和+3。砷的电负性比镓__________(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:__________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是_______________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为__________,草酸根中碳原子的杂化方式为__________。

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,该晶体的类型为__________,晶体的密度为__________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。