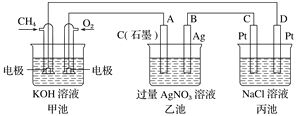
��Ŀ����
����Ŀ��B��C��N��O��Si��S �Ǽ��ֳ�������Ҫ�ǽ���Ԫ�أ����γɵĸ��ֻ���������Ȼ���й㷺����
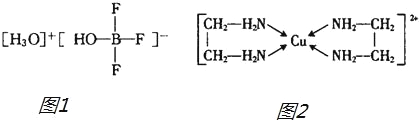
��1��Siλ��Ԫ�����ڱ���______����______�壻��̬��ԭ�ӵĵ����Ų�ʽΪ______��C��N��SiԪ��ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ______��
��2��BF3��һ������ˮ���γ���ͼ1����R������R�и������������������______������ĸ����
a�����Ӽ� b�����ۼ� c�����»��� d��������
��3���Ҷ�����H2N��CH2��CH2��NH2����CuCl2��Һ���γ������ӣ��ṹ��ͼ2�����Ҷ��������װ�[N��CH3��3]�����ڰ������Ҷ��������װ��ķе�ߵö࣬ԭ����______��
��4����25�桢101kpa��NO2��g����SO2��g����Ӧ���� SO3��g���� NO��g������֪ÿ����1gSO3��g���ų����� 0.52kJ���÷�Ӧ���Ȼ�ѧ����ʽ��______��
��5����ɰ��Na2B4O710H2O��������������ɱ�����������ˮ����������Һ�л�����H3BO3���÷�Ӧ�����ӷ���ʽΪ______��
���𰸡� �� ��A 1s22s22p1 N��C��Si ab �Ҷ�������֮��� ���γ���������װ�����֮�䲻���γ���� NO2��g��+SO2��g��=SO3��g��+NO��g����H=��41.6kJ/mol B4O72��+2H++5H2O=4H3BO3
��������
(1) ����14��Ԫ�أ�λ�ڵ������ڣ��ڢ�A�壬���ݹ���ԭ��д����ԭ�ӵĺ�������Ų�ʽ��ͬһ����Ԫ�صĵ�һ����������ԭ������������������������������IIA��͵�VA��Ԫ�صĵ�һ�����ܴ�������Ԫ����
(2)����R�и���������������漰���Ӽ������ۼ�����λ����
(3�Ҷ�����H2N��CH2��CH2��NH2������֮������γ�����������װ�[N��CH3��3]����֮�䲻���γ������
(4)�����Ȼ�ѧ����ʽ����д������ע�����⣬��ע��Ӧ��Ӧ���ʱ�д�����ɷ�Ӧ����ʽ��֪��NO2��g��+SO2��g��=SO3��g��+NO��g�������80g��������ų���������
(5)��ɰ�Ļ�ѧʽΪNa2B4O710H2O����H2SO4��pHΪ2��3����ɰ�е� Na2B4O7������Һ������H3BO3����Ӧ�����ӷ���ʽΪ��B4O72��+2H++5H2O=4H3BO3��
��1������14��Ԫ�أ�λ�ڵ������ڣ��ڢ�A�壬��ԭ�Ӻ�����5�����ӣ����������Ų�ʽΪ��1s22s22p1��ͬһ����Ԫ�صĵ�һ����������ԭ�����������������������ƣ�����IIA��͵�VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�����C��N��Si����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ��N��C��Si��
��ˣ������Ϊ��������A��1s22s22p1��N��C��Si��
��2������ R �и���������������漰���Ӽ������ۼ�����λ����
��ˣ������Ϊ��ab��
��3���Ҷ�����H2N��CH2��CH2��NH2������֮������γ���������װ�[N��CH3��3]����֮�䲻���γ���������Ҷ����ķе�ϸߡ�
��ˣ������Ϊ���Ҷ�������֮��� ���γ���������װ�����֮�䲻���γ������
��4���ɷ�Ӧ����ʽ��֪��NO2��g��+SO2��g��=SO3��g��+NO��g����1gSO3��g���ų����� 0.52kJ������ 80g��������ų�������Ϊ��80��0.52kJ=41.6kJ�������Ȼ�ѧ����ʽΪ��NO2��g��+SO2��g��=SO3��g��+NO��g����H=��41.6kkJ/mol��
��ˣ������Ϊ��NO2��g��+SO2��g��=SO3��g��+NO��g����H=��41.6kJ/mol
��5����ɰ�Ļ�ѧʽΪNa2B4O710H2O����H2SO4��pHΪ2��3����ɰ�е� Na2B4O7������Һ������H3BO3����Ӧ�����ӷ���ʽΪ��B4O72��+2H++5H2O=4H3BO3��
��ˣ������Ϊ��B4O72��+2H++5H2O=4H3BO3

 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�����Ŀ�����ж��й��������ϵ������������ȷ���ǣ� ��
ѡ�� | �� | ���ϵ | �������� |
A | C60��C70��C540 | ͬλ�� | ����ֻ���Ǽ��Թ��ۼ� |
B | ���顢2��2���������� | ͬ���칹�� | ���³�ѹ�³���̬ |
C |
| ͬ�������� | ������������ʱ�Ĵ��� |
D | ���ᡢӲ֬�� | ͬϵ�� | �ܷ���������Ӧ |
A. A B. B C. C D. D
����Ŀ��COS ��H2S ������ú������Ʒ��ԭ��������֪��
��.COS(g)+H2(g)![]() H2S(g)+CO(g) ��H=X kJ��mol-1��
H2S(g)+CO(g) ��H=X kJ��mol-1��
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-42 kJ��mol-1��
CO2(g)+H2(g) ��H=-42 kJ��mol-1��
��1������1mol�����еĻ�ѧ���������յ��������±���ʾ��
���� | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
����/kJ��mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
��X=_____________________��
��2����10 L�ݻ�������ܱ������г���1mol COS(g)��1mol H2(g)��1mol H2O(g)����������������Ӧ����ij�¶��´ﵽƽ�⣬��ʱCO���������Ϊ4%���Ҳ�ô�ʱCOS�����ʵ���Ϊ0.80mol������¶��·�ӦI��ƽ�ⳣ��Ϊ_________________��������λ��Ч���֣�
��3������������ͬ��2 L���ݾ��ȣ������û�������������ܱ�����M��N����M �г���1mol CO��1molH2O����N �г���1molCO2��1molH2������700���¿�ʼ������з�Ӧ���ﵽƽ��ʱ������˵����ȷ����_________��
A.��������CO �����ʵ���M>N
B.������������Ӧ����M
C.����M ��CO��ת����������N ��CO2��ת����֮��С��1
D.�������з�Ӧ��ƽ�ⳣ��M>N
��4�������ᡢ̼���Ϊ��Ԫ���ᣬ�䳣���µĵ��볣�����±���
H2CO3 | H2S | |
Ka1 | 4.4�� 10-7 | 1.3��10-7 |
Ka2 | 4.7�� 10-11 | 7.1��10-15 |
ú�����������в�����H2S ����������Na2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽΪ______________�������£���100mL0.2mol��L-1InaOH��Һ����448mL�������H2S���壬��Ӧ����Һ������Ũ�ȴӴ�С��˳��Ϊ__________________________________��
��5��25��ʱ����Na2S����Cu2+��Sn2+���ֽ������� (M2+)������S2-���Ũ�ȵĶ���ֵ1gc(S2-
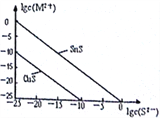
��25��ʱKsp(CuS)=_______________��
��25��ʱ��50mL��Sn2+��Cu2+Ũ�Ⱦ�Ϊ0.01mol/L�Ļ����Һ����μ���Na2S��Һ����Na2S��Һ�ӵ�150mLʱ��ʼ����SnS���������ʱ��Һ��Cu2+Ũ��Ϊ_____________mol/L��
����Ŀ��������������3�������Ϊ0.5L�ĺ����ܱ��������������������а���ͬͶ�ϱ�(Z)����HCl��O2(���±�)���������������Ӧ��4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)��H��HCl��ƽ��ת������Z��T�Ĺ�ϵ��ͼ��ʾ��
2Cl2(g)+2H2O(g)��H��HCl��ƽ��ת������Z��T�Ĺ�ϵ��ͼ��ʾ��
���� | ��ʼʱ | ||
T/�� | n(HCl)/mol | Z | |
�� | 300 | 0.25 | a |
�� | 300 | 0.25 | b |
�� | 300 | 0.25 | 4 |
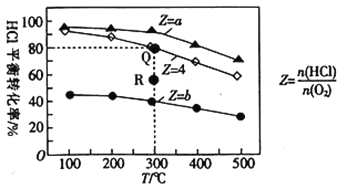
����˵������ȷ������ ��
A. ��H<0
B. a<4<b
C. ����������Ӧijʱ�̴���R������R��ķ�Ӧ���ʣ�v(��)>v(��)
D. 300��ʱ���÷�Ӧƽ�ⳣ����ֵΪ320