题目内容
【题目】下列离子方程式正确的是( )
A. Fe2O3溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
B. Na2SO3与稀硝酸:SO32-+2H+=SO2↑+H2O
C. AlCl3溶液中加入足量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O
【答案】D
【解析】由于Fe3+具有较强氧化性,而I-具有还原性,Fe2O3溶于氢碘酸的离子方程式是Fe2O3+6H++2I-=2Fe2++I2+3H2O,故A错误; SO32-具有还原性、稀硝酸具有氧化性,Na2SO3与稀硝酸的离子方程式是:3SO32-+2H++2NO3-= 3SO42-+H2O+2NO,故B错误; AlCl3溶液中加入足量的氨水:Al3++3NH3·H2O=Al(OH)3![]() +3NH4+,故C错误;Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O,故D正确。
+3NH4+,故C错误;Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O,故D正确。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
【题目】有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
容器 | 起始时 | ||
T/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
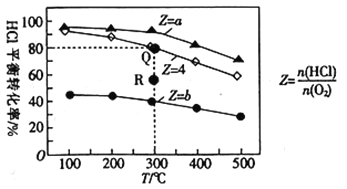
下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300℃时,该反应平衡常数的值为320