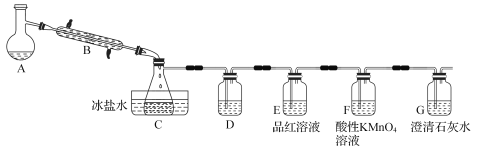
题目内容
【题目】氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
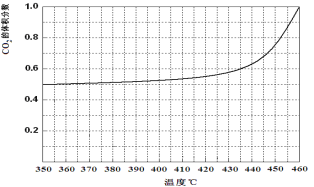
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见右图,图中曲线a表示H2S的平衡转化率与温度关系,曲线表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H______0,(“>”、“<”或“=”),
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:______。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=______;
CaCO3(s)+2H2(g)的△H=______;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=_____________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是______。(填字母编号)
A.降低体系的温度
B.压缩容器的体积
C.适当增加水蒸气的通入量
D.增加CaO的量
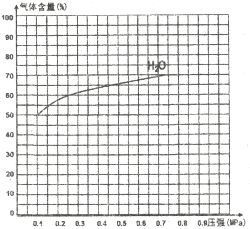
③下图为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。
【答案】(1)>;②![]() mol/(L·min);③温度升高,反应速率加快,达到平衡所需时间缩短;
mol/(L·min);③温度升高,反应速率加快,达到平衡所需时间缩短;
(2)-90.3;K1·K2·K3;②AC;③ ;
;
【解析】
试题分析:(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,故答案为:>;
②H2S的起始浓度均为c mol?L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol?L-1×40%=0.4cmol?L-1,v= ![]() =
= ![]() mol/(L·min),故答案为:
mol/(L·min),故答案为:![]() mol/(L·min);
mol/(L·min);
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;故答案为:温度升高,反应速率加快,达到平衡所需时间缩短;
(2)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.0kJmol-1
②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-43kJmol-1
③CaO(s)+CO2(g)=CaCO3(s)△H=-178.3kJmol-1
根据盖斯定律,①+②+③得C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g),
故△H=+131.0kJmol-1+(-43kJmol-1)+(-178.3kJmol-1)=-90.3kJmol-1,故答案为:-90.3;
已知:I:C(s)+H2O(g)═CO(g)+H2(g) K1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3
反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),则K=K1·K2·K3;
故答案为:-90.3;K1·K2·K3;
②提高H2产量,则需使平衡正向移动,已知C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),A.该反应为放热反应,降低体系的温度,平衡正移,则能提高H2产量,故A正确;B.压强增大,平衡不移动,所以H2产量不变,故B错误;C.适当增加水蒸气的通入量,平衡正移,则能提高H2产量,故C正确;D.增加CaO的量,对平衡无影响,所以H2产量不变,故D错误;故答案为:AC;
CaCO3(s)+2H2(g),A.该反应为放热反应,降低体系的温度,平衡正移,则能提高H2产量,故A正确;B.压强增大,平衡不移动,所以H2产量不变,故B错误;C.适当增加水蒸气的通入量,平衡正移,则能提高H2产量,故C正确;D.增加CaO的量,对平衡无影响,所以H2产量不变,故D错误;故答案为:AC;
③反应中H2O的变化量约等于CO的变化量,当起始水的含量为50%,则H2、CO各占25%,则CO的曲线的起点坐标为(0.1,25),平衡时水的含量为70%,则H2、CO各占15%,H2O含量变化与CO含量变化关于含量y=37.5的直线对称,故图中CO的变化曲线示意图为: ,故答案为:
,故答案为: 。
。

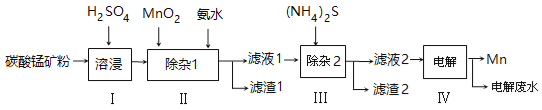
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)