题目内容
12.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2,NO和H2O.当产物n(NO2):n(NO)=1:1时,下列说法错误的是( )| A. | 1 mol Cu2S参加反应时有10 mol电子转移 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 反应中Cu2S作还原剂 | |
| D. | 产物n[Cu(NO3)2]:n[CuSO4]=l:1 |
分析 由信息可知,n(NO2):n(NO)=1:1,假定生成1molNO2、1molNO;则HNO3被还原生成1molNO2、1molNO共得4mole-;Cu2S应失4mole-.而1molCu2S能失10mole-,故失4mole-说明反应的Cu2S的物质的量为0.4mol,0.4molCu2S生成0.4molCuSO4和0.4molCu(NO3)2;即起酸性作用的HNO3的物质的量为0.8mol,起氧化作用的HNO3为2mol.反应的HNO3共2.8mol,故n(Cu2S):n(HNO3)=0.4mol:2.8mol=2:14,则发生2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O,Cu、S元素的化合价升高,N元素的化合价降低,结合化学方程式的定量关系和氧化还原反应关系分析判断.
解答 解:A.1 molCu2S参加反应时有1mol×2×(2-1)+1mol×[6-(-2)]=10mol电子转移,故A正确;
B.由2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O可知,参加反应的n(Cu2S):n(HNO3)=2:14,故B错误;
C.Cu、S元素的化合价升高,Cu2S做还原剂,故C正确;
D.由发生的反应可知,产物n[Cu(NO3)2]:n[CuSO4]=1:1,故D正确;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
15.设NA为阿伏伽德罗常数,下列叙述错误的是( )
| A. | 等物质的量的N2和CO所含分子数不一定为NA | |
| B. | S.T.P下22.4L CH4所含电子数目为10NA | |
| C. | 1molF-含质子数与电子数之和为10NA | |
| D. | 1molOH-中所含中子数为8NA |
20.有机物甲的分子式为C7H12O2,是一种六元环状酯,且甲的分子中含有2甲基,则甲的可能结构有( )
| A. | 6 种 | B. | 8 种 | C. | 10 种 | D. | 14 种 |
7.下列实验操作中错误的是( )
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 过滤操作时,向过滤器中倾倒液体时一定要用玻璃棒引流 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
17.请将下列实验错误操作可能会引起的不良后果填在表格中.
| 实验 | 向试管中加锌粒 | 对量筒中液体读数 | 浓H2SO4 |
错误操作 |  |  |  |
不良后果 |
4.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为0.13mol/(L•min)(保留小数点后二位数).
②实验2条件下平衡常数表达式K=$\frac{c({CO}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数表达式K=$\frac{c({CO}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol.
2.既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
| A. | 与足量高锰酸钾酸性溶液反应 | B. | 与足量溴水反应 | ||
| C. | 在一定条件下通入氢气 | D. | 分别进行燃烧 |
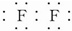 .
.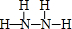 .D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为N2H4+2H2O2=N2+4H2O.
.D与C反应可生成对环境没有影响的两种物质,一种是大气的主要成分,另一种在常温下是无色液体,该反应的化学方程式为N2H4+2H2O2=N2+4H2O.