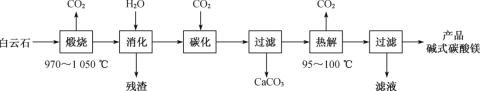
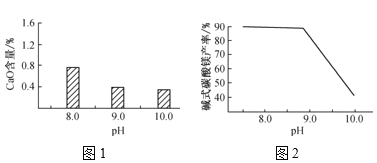
题目内容
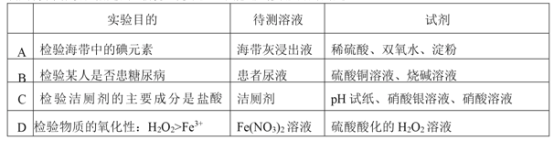
【题目】常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的的c(H+)与NaOH溶液的体积之间的关系如图所示,下列推断正确的是( )
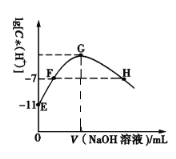
A. 可用pH试纸测定E点对应溶液,其pH=3
B. G点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
C. H、 F点对应溶液中都存在:c(Na+)=c(Cl-)+c(ClO-)
D. 常温下加水稀释H点对应溶液,溶液的pH增大
【答案】B
【解析】
A.E点新制氯水溶液,溶液显酸性,由水电离出的c水(H+)=10-11mo/L,溶液中OH-完全是由水电离出来的,所以c(OH-)=c水(H+)=10-11mo/L,则溶液中c(H+)=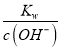 =10-3mol/L,则溶液pH=3,但新制氯水有漂白性,不能用pH试纸测量其pH,应该用pH计,选项A错误;
=10-3mol/L,则溶液pH=3,但新制氯水有漂白性,不能用pH试纸测量其pH,应该用pH计,选项A错误;
B.G点,氯水与氢氧化钠溶液恰好完全反应生成等物质的量的NaCl、NaClO,ClO-水解使溶液呈弱碱性,所以有c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),选项B正确;
C.F点对应溶液中溶质为NaCl、NaClO和NaOH,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),此时溶液为碱性,则c(OH-)>c(H+),所以c(Na+)>c(Cl-)+c(ClO-),选项C错误;
D.加水稀释H点对应的溶液,H点为碱性溶液,加水稀释时促使溶液的碱性减弱,所以pH值降低,选项D错误;
答案选B。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol/L KCl溶液,振荡 | |
实验④:滴加4滴1 mol/L KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡 |
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动