题目内容
【题目】将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol/L KCl溶液,振荡 | |
实验④:滴加4滴1 mol/L KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡 |
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
【答案】B
【解析】
A. 对比实验①和②,增加了反应物Fe3+的浓度,平衡正向移动,故A正确;
B. 对比实验①和③,仅仅是氯离子浓度增加,但反应的实质是Fe3+ +3SCN-![]() Fe(SCN)3, 反应的离子浓度不变,平衡不发生移动,故B错误;
Fe(SCN)3, 反应的离子浓度不变,平衡不发生移动,故B错误;
C. 对比实验①和④,增加反应物SCN-的浓度,平衡正向移动,故C正确;
D. 对比实验①和⑤,OH-与Fe3+反应,减少反应物Fe3+的浓度,平衡逆向移动,故D正确。
综上所述,答案为B。

 期末冲刺100分创新金卷完全试卷系列答案
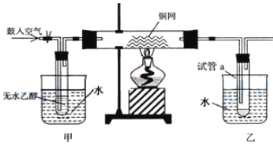
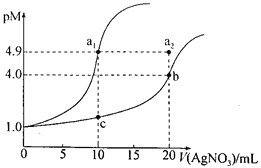
期末冲刺100分创新金卷完全试卷系列答案【题目】知识的梳理和感悟是有效学习的方法之一。山大附中高二化学兴趣小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(所有电极均为石墨)。电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42﹣及泥沙,其精制流程如下:
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如表。
Ca(OH)2 | Mg(OH)2 | |
pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)=1.1×10﹣10,Ksp(BaCO3)=2.6×10﹣9,Ksp(CaCO3)=5.0×10﹣9
(1)盐泥a除泥沙外,还含有___________(填化学式)。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________。
(3)过程Ⅲ中,沉淀c主要成分的化学式为_____。
(4)过程Ⅳ调pH目的是除去___________(填离子符号)
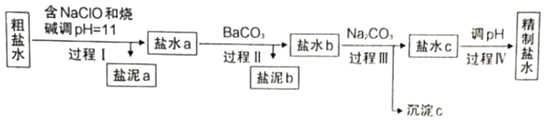
(5)利用图1装置电解精制氯化钠一段时间后,气球b中的气体是_____(填化学式)
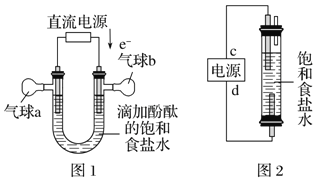
(6)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分NaClO,则c为电源的_____极;该发生器中反应的总离子方程式为_______________。
(7)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
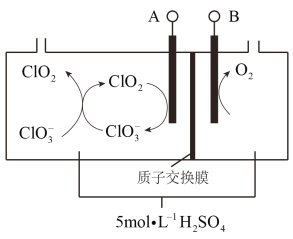
①阴极发生的反应有:_______________、__________________________。
②当阳极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为_____。
【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大