题目内容
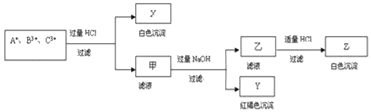
【题目】含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化后逐一沉淀出来,其中B3+转入白色沉淀:
请通过分析回答(用化学符号填写):
(1)A+是__,B3+是__,C3+是__;
(2)X是__,Y是__,Z是__;
(3)写出下列离子方程式:
①生成Y沉淀:__;②B3+与过量氨水反应:__;
(4)写出下列化学方程式:单质铝和Y分解后的固体产物反应:__.
【答案】Ag+ Al3+ Fe3+ AgCl Fe(OH)3 Al(OH)3 Fe3++3OH﹣═Fe(OH)3↓ Al3++3NH3H2O═Al(OH)3↓+3NH4+ 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】
含有A+、B3+、C3+ 三种金属阳离子的水溶液,加入过量盐酸反应过滤得到白色沉淀X和滤液甲,白色沉淀只能是氯化银沉淀,说明A+离子为Ag+,滤液甲中加入过量氢氧化钠溶液过滤得到红褐色沉淀Y为Fe(OH)3,滤液乙中加入适量盐酸反应生成白色沉淀Z为Al(OH)3,其中B3+转入白色沉淀,则B3+、C3+ 离子分别为:Al3+、Fe3+,据此回答;
(1)由上述分析可知A+、B3+、C3+ 三种金属阳离子分别为:Ag+、Al3+、Fe3+,
答案为:Ag+;Al3+;Fe3+;
(2)分析可知对应X、Y、Z分别为:AgCl、Fe(OH)3、Al(OH)3;
故答案为:AgCl; Fe(OH)3;Al(OH)3;
(3)①生成Y沉淀的离子方程式为:Fe3++3OH﹣═Fe(OH)3↓;
故答案为:Fe3++3OH﹣═Fe(OH)3↓;
②Al3+与过量氨水反应生成氢氧化铝沉淀和铵根离子,离子方程式为:Al3++3NH3H2O═Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3H2O═Al(OH)3↓+3NH4+;
(4)氢氧化铁分解产物是氧化铁,铝与氧化铁在高温下反应生成铁和氧化铝,放出大量的热,反应方程式为:2Al+Fe2O3![]() 2 Fe+Al2O3;
2 Fe+Al2O3;
故答案为:2Al+Fe2O3![]() 2 Fe+Al2O3。
2 Fe+Al2O3。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案