题目内容
4.具有下列结构的原子一定属于第二主族的是( )| A. | 最外层电子数与次外层电子数相等的原子 | |
| B. | M层电子数为K层电子数一半的原子 | |
| C. | 最外层有2个电子的原子 | |
| D. | M层电子数等于其内层电子数之和$\frac{1}{5}$的原子 |
分析 A、18号元素Ar,最外层和次外层电子数都是8;
B、M层电子数为K层电子数一半的原子,是钠第ⅠA族元素;
C、氦最外层两个电子;
D、M层电子数等于其内层电子数之和$\frac{1}{5}$的原子,是镁元素.
解答 解:A、18号元素Ar,最外层和次外层电子数都是8,但是0族元素,而不是第二主族,故A错误;
B、M层电子数为K层电子数一半的原子,是钠第ⅠA族元素,不是第二主族,故B错误;
C、氦最外层两个电子,是0族元素,而不是第二主族,故C错误;
D、M层电子数等于其内层电子数之和$\frac{1}{5}$的原子,是镁元素,是第ⅡA族元素,故D正确;
故选D.
点评 本题考查结构与位置的关系,难度不大,注意掌握元素周期表中各族元素结构特点.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
14.下列关于有机物的命名中不正确的是( )
| A. | 2,2─二甲基戊烷 | B. | 3,4─二甲基辛烷 | C. | 2-甲基-3-丁炔 | D. | 1,3─丁二烯 |
12.糖类、油脂和蛋白质都是人类必需的基本营养物质,下列关于它们的说法中不正确的( )
| A. | CuSO4溶液能使蛋白质变性 | |
| B. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 淀粉、油脂和蛋白质都能发生水解反应 |
9.根据表中左栏信息,回答右栏有关问题:
| 信 息 | 问 题 |
| ①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数.其中X是形成化合物种类最多的元素. | (1)X元素的最高价氧化物的电子式是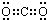 |
| ②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液. | (2)Z元素在元素周期表中位于第 三周期, ⅢA族. |
| ③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成. | (3)写出生成白色沉淀的化学方程式 MgCl2+2NaOH═Mg(OH)2↓+2NaCl. |
| ④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量 的盐酸溶液,最终溶液中有白色沉淀. | (4)最终生成白色沉淀的离子方程式为 SiO32-+2H+=H2SO3↓. |
| (5)X、Y、Z、W四种元素的原子半径由大到小的顺序为 Mg>Al>Si>C(用元素符号表示) | |
16.由于某一条件的改变容器的平衡3A(g)+B(g)?2C(g)△H<0,向正反应方向发生了移动.新的平衡状态与原平衡状态相比,下列判断中不正确的是( )
①容器内的温度一定升高
②v正一定变大
③容器中C物质的浓度一定升高
④容器内的压强一定降低.
①容器内的温度一定升高
②v正一定变大
③容器中C物质的浓度一定升高
④容器内的压强一定降低.
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③④ |
13.研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标.目前液氨被人们视为一种潜在的清洁燃料.液氨燃烧的化学反应方程式为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.和氢燃料相比有关数据见下表,据此判断正确的是( )
①以氨和氢为燃料时,均可以减缓温室效应
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氨放出的热量多
④氨的液化比氢容易得多.
| 燃料 | 沸点/℃ | 燃烧热/(kJ•mol-1) | 相对分子质量/(g•mol-1) | 液态密度/(g•cm-3) |
| 氢 | -252.60 | 238.40 | 2.02 | 0.07 |
| 氨 | -33.50 | 317.10 | 17.03 | 0.61 |
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氨放出的热量多
④氨的液化比氢容易得多.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
14.下列各有机物在一定的条件下能发生消去反应的是( )
| A. | CH3Cl | B. | (CH3)3CCH2OH | C. | (CH3)3CCl | D. | 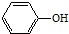 |
 .
. .
.