题目内容
19.氮元素可以形成多种化合物.回答以下问题:(1)基态氮原子的价电子排布式是2s22p3.
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4的结构式为
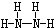 .
.②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有3mol.
③肼能与硫酸反应生成N2H6SO4.N2H6SO4与硫酸铵晶体类型相同,则N2H6SO4的晶体内不存在D
A.离子键 B.共价键 C.配位键 D.范德华力
(3)FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是K2Fe(SCN)5.KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是
 .
.(4)美国科学家合成了结构呈“V”形对称的N5+,已知该离子中各原子均达到8电子稳定结构.则有关该离子的下列说法中正确的是B.
A.每个N5+中含有35个质子和36个电子 B.该离子中有非极性键和配位键
C.该离子中含有2个π键 D.与PCl4+互为等电子体
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.
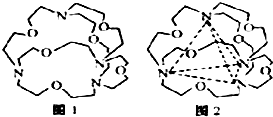
下列分子或离子中,能被该有机化合物识别的是c(填标号).
a.CF4 b.CH4 c. NH4+ d.H2O
(6)N的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为直线形,阳离子中氮的杂化方式为sp.
分析 (1)N原子核外有7个电子,最外层有5个电子,根据构造原理顺序其价电子排布式;
(2)①N2H4中原子间以单键形式存在;
②若该反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1中有4molN-H键断裂,说明有1mol肼参加反应,有1.5mol氮气生成,每个氮气分子中含有两个π键,据此计算形成的π键的物质的量;
③根据硫酸铵晶体中存在的化学键判断;
(3)根据化学式中化合价的代数和为零来书写化学式;氧与硫的最外层电子数相同,先确定SCN-中各原子的连接顺序以及成键方式,再结合离子电子式的书写方法书写.
(4)A.N5+是由N5分子失去1个电子得到的,1个N5分子是由5个氮原子构成的,据此进行分析解答.
B.同种非金属元素之间形成非极性共价键,不同种非金属元素之间形成极性共价键,含有孤电子对和含有空轨道的原子之间能形成配位键,配位键属于共价键;
C.1个氮氮三键中含有2个π键;
D.根据具有相同原子数和价电子数的微粒互称为等电子体;
(5)本题中嵌入某微粒分别与4个N原子形成4个氢键;
(6)氮是7号元素,价电子数是5,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为$\frac{5-1}{2}$=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,据此答题.
解答 解:(1)氮原子的电子排布式1s22s22p3,其价层电子排布式为2s22p3,故答案为:2s22p3;
(2)①N2H4分子中每个N原子和两个H原子形成两个共价单键,N原子之间存在共价单键,所以其结构式为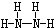 ,
,
故答案为: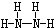 ;
;
②若该反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1中有4molN-H键断裂,说明有1mol肼参加反应,有1.5mol氮气生成,每个氮气分子中含有两个π键,所以形成的π键有3mol,
故答案为:3;
③3N2H6SO4和(NH4)2SO4都是离子晶体,N2H6 2+和SO42-之间存在离子键,N2H62+中N和H之间形成6个共价键(其中2个配位键),N和N之间形成共价键,SO42-中S和O之间形成共价键,不含范德华力,
故选:D;
(3)FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是K2Fe(SCN)5;SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN-得到的一个电子给了S,故SCN-的电子式 ,
,
故答案为:K2Fe(SCN)5; ;
;
(4)A.1个氮原子中含有7个质子、7个电子,则1个N5分子中含有35个质子、35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有35个质子,34个电子,故A错误;
B.N5+中氮氮三键是非极性共价键,中心的氮原子有空轨道,两边的两个氮原子提供孤电子对形成配位键,故B正确;
C.1个氮氮三键中含有2个π键,所以该离子中含有4个π键,故C错误;
D.N5+和PCl4+具有相同原子数,但价电子数分别为24,27,不是等电子体,故D错误;
故答案为:B;
(5)注意氢键的形成条件及成键元素(N、O、F、H),本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+,
故答案为:c;
(6)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为:$\frac{5-1}{2}$=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,
故答案为:直线,sp.
点评 本题考查考查原子结构与性质,涉及核外电子排布、电离能的大小比较、杂化类型、配位键等知识,综合考查学生的分析能力和基本概念的综合运用能力,为高考常见题型和高频考点,注意相关基础知识的学习,难度中等.

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | 晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类 | |
| B. | 任何晶体中都含有化学键,如离子键、共价键、金属键、氢键等 | |
| C. | 含有阳离子的晶体一定是离子晶体 | |
| D. | 干冰和冰都属于分子晶体 |
| A. | 最外层电子数与次外层电子数相等的原子 | |
| B. | M层电子数为K层电子数一半的原子 | |
| C. | 最外层有2个电子的原子 | |
| D. | M层电子数等于其内层电子数之和$\frac{1}{5}$的原子 |
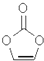
| A. | 分子式为C3H4O3 | B. | 分子中含8个σ键 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |

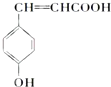 .
.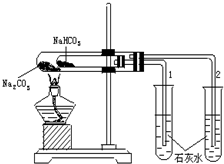 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答: