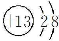题目内容
16.写出下列微粒的电子式:H2O:
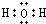 CO2:
CO2: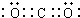 MgCl2:
MgCl2: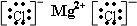 Na2O2:
Na2O2: .
.
分析 根据电子式与结构式的书写规则书写,注意正确判断物质所含的化学键类型.
解答 水分子为共价化合物,分子中1个氧原子分别与2个氢原子共用1对电子,所以存在两个氧氢键,水的电子式为: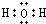 ;
;
CO2是共价化合物,碳原子和氧原子之间有2对共用电子对,其电子式为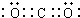 ;
;
Mg失去2个电子,被2个氯原子分别得到1个形成氯离子,则氯化镁的电子式为: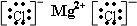 ;
;
过氧化钠为离子化合物,化合物中存在钠离子和过氧根离子,过氧化钠的电子式为: ,
,
故答案为: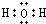 ;
;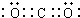 ;
;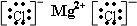 ;
; .
.
点评 本题考查了电子式的书写,题目难度中等,试题题量较大,充分考查了学生对书写知识的掌握情况,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
(3)求该混合物中Be2C与CaC2的物质的量之比.
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(1)某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为66.7%.
(2)已知2Mg3N2+3CO2→3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加3.8g.
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如表:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 6.2 | 9.3 | 15.5 | 21.7 |
| 水(mL) | 18 | 18 | 18 | 18 |
| 气体(L,标准状况) | 3.36 | 5.04 | 8.4左右 | 8.4左右 |
(4)与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
11.在研究物质变化时,人们可以从不同的角度,不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( )
| A. | 化学反应的实质是旧键的断裂和新化学键生成 | |
| B. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| C. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 | |
| D. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
1.如表实验所用的试剂不合理的是( )
| 选项 | 实验目的 | 所用试剂 |
| A | 比较Fe3+和Cu2+的氧化性 | FeCl3溶液和Cu |
| B | 比较镁和铝的金属性 | MgCl2溶液、AlCl3溶液、NaOH溶液 |
| C | 比较硫和氯的非金属性 | 氢硫酸、氯气 |
| D | 比较苯酚和碳酸的酸性 | 0.1mol/L苯酚钠、0.1mol/L碳酸钠溶液pH试纸 |
| A. | A | B. | B | C. | C | D. | D |
18.下表是3种物质的溶解度(20℃),下列说法正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
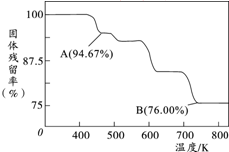 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.
 B.
B. C.
C. D.
D.