题目内容
19.常温下,下列各溶液的叙述正确的是( )| A. | pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,则a+1=b | |
| D. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.溶液pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(HSO3-)+2c(SO32-);
B.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③醋酸根离子水解促进铵根离子水解;④弱碱电离,且电离的程度很弱;
C.醋酸的浓度越大,电离程度越小;
D.反应后溶质为等浓度的醋酸钠和醋酸,溶液为酸性,则醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),再结合物料守恒可得c(CH3COO-)>c(Cl-)>c(CH3COOH).
解答 解:A.pH=7的NaHSO3与Na2SO3混合溶液中:c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(HSO3-)+2c(SO32-),故A错误;
B.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4④NH3•H2O,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③醋酸根离子水解促进铵根离子水解;④弱碱电离,且电离的程度很弱,则c(NH4+)由大到小的顺序是①>②>③>④,故B正确;
C.0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,前者醋酸的电离程度越小后者,则a+1>b,故C错误;
D.0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则c(H+)>c(OH-),溶质为等浓度的醋酸钠和醋酸,溶液为酸性,则醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),再结合物料守恒可知c(CH3COO-)>c(Cl-)>c(CH3COOH),则溶液中正确的离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断、离子浓度大小比较等知识,明确反应后溶质组成为解答关键,C为易错点,注意醋酸浓度越大,电离程度越小.

 新题型全程检测期末冲刺100分系列答案
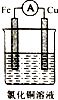
新题型全程检测期末冲刺100分系列答案(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
写出反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
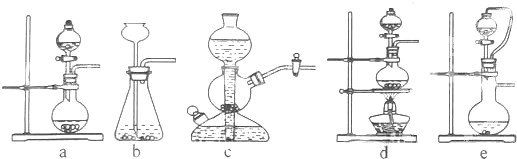
如果硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是ae (填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠19.8 g (保留一位小数).
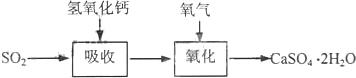
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图:
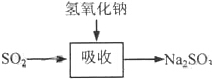
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
| A. | 由甲烷制氯仿 | |
| B. | 乙烯水化法制乙醇 | |
| C. | 甲苯和浓硝酸制TNT | |
| D. | 油脂与浓NaOH溶液反应制高级脂肪酸钠 |
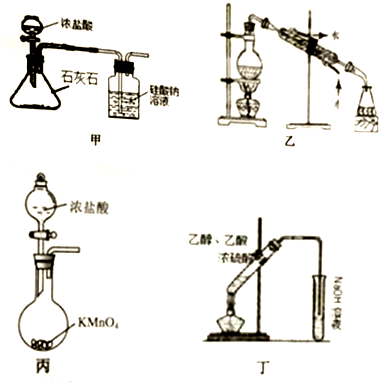
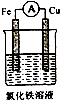
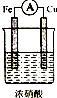
| A. | 装置甲:验证碳的非金属性比硅强 | |
| B. | 装置乙:石油分馏分别得到汽油、柴油、煤油 | |
| C. | 装置丙:实验室制取氯气的反应发生装置 | |
| D. | 装置丁:实验室制取乙酸乙酯 |
| A. | CO2的电子式: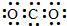 | B. | 乙烯的比例模型: | ||
| C. | 醋酸钠的分子式:C2H3O2Na | D. | C原子最外层电子的轨道表示式: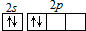 |

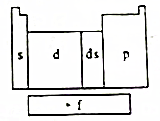 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.
在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.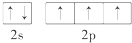 ;
;