题目内容
9.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
写出反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
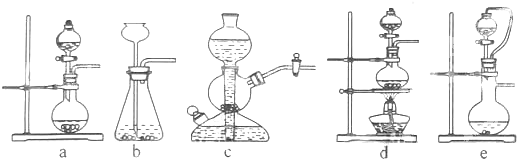
如果硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是ae (填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠18.9g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠19.8 g (保留一位小数).
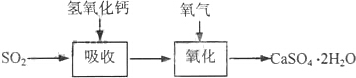
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4•2H2O.其流程如图:
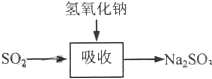
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可特点进行判断;
(2)由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量;设没有变质的亚硫酸钠为100g,根据变质的质量计算出变质后溶液中亚硫酸钠的质量分数,再计算出需要变质后的亚硫酸钠的质量;
(3)根据石灰-石膏法和碱法吸收二氧化硫的原理分析相同之处;利用题中已知信息及反应原理判断石灰-石膏法的优点和缺点.
解答 解:(1)与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;ae;
(2)由硫守恒可得:Na2SO3~SO2,因此需称取亚硫酸钠的质量为:m(Na2SO3)=126g•mol-1×$\frac{3.36L}{22.4L/mol}$=18.9g;
设没有变质的亚硫酸钠为100g,则有4g亚硫酸钠被氧化成硫酸钠,4g亚硫酸氧化为硫酸钠后质量变为:4g×$\frac{142}{126}$=4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:$\frac{100g-4g}{100g-4g+4.5g}$×100%=95.5%,
因此称取变质后样品的质量应为:$\frac{18.9g}{95.5%}$=19.8g;
故答案为:18.9;19.8;
(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等;由于吸收产物亚硫酸钙由管道输送至氧化塔氧化,所以缺点为亚硫酸钙在输送中容易造成管道堵塞,导致吸收速率慢、效率低,
故答案为:利用SO2是酸性氧化物,可与碱反应;原料易得,吸收成本低;亚硫酸钙在输送中容易造成管道堵塞,吸收速率慢,效率低.
点评 本题考查了制备气体实验装置的选择方法、含硫化合物性质及综合应用,题目难度中等,注意掌握化学实验基本操作方法,明确反应原理为解答关键.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案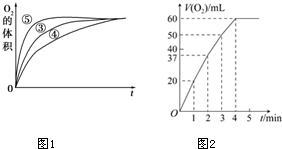 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分组实验 | 催化剂 | |
| ① | 10mL 5% H2O2溶液 | 无 |
| ② | 10mL 2% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
 .
.(2)实验①和②的目的是探究反应物浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论:碱性环境能增大H2O2分解的速率;酸性环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因:随着反应的进行,H2O2的浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11mol/L.(保留两位有效数字,在标准状况下测定)
| A. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 不慎将油汤洒在衣服上可用酒精、汽油等除去,它们能将油污从汤液中萃取出来而除去 | |
| D. | 玻璃是用石灰石,纯碱和二氧化硅等原料熔炼而成,在熔炼过程中发生了化学变化 |
| A. | Al3+、Cl-、Ca2+ | B. | Mg2+、SO42-、OH- | C. | Na+、SO32-、H+ | D. | H+、K+、OH- |
| A. | 氢氧化钠与盐酸的反应 | B. | H+Cl→HCl | ||
| C. | 氯化铵与氢氧化钡晶体反应 | D. | 金属钠与水反应 |
| A. | 用pH试纸测氯水的pH | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 中和滴定时锥形瓶使用前需用待测液润洗 | |
| D. | 用CS2可除去试管内壁残留的S |
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,则a+1=b | |
| D. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
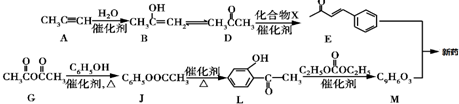
 .
.