题目内容
11.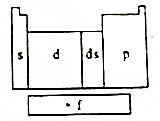 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.
在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.(1)在s区中,族序数最大、原子序数最小的元素原子的价电子的电子云形状为球形;
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5,其中较稳定的是Fe3+;
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为3d104s2;
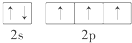
(4)在p区中,第二周期VA族元素原子的价电子排布图为
 ;
;(5)在今常用于核能开发的元素是铀和钚,它们在f区中.
分析 (1)在s区中,族序数最大的元素为第ⅡA族,其原子的价电子排布式应为ns2;
(2)在d区中,族序数最大、原子序数最小的元素为Fe,常见离子为亚铁离子、铁离子,根据洪特规则特例判断离子稳定性;
(3)在ds区中,原子序数最大的元素为第ⅡB族,原子的价电子排布式应为3d104s2;
(4)在p区第2周期、ⅤA族元素为N,原子价电子排布为2s22p3;
(5)常用于核能开发的元素是铀和钚,它们在f区中.
解答 解:(1)在s区中,族序数最大的元素为第ⅡA族,其原子的价电子排布式应为ns2,所以其原子的价电子的电子云形状为球形,故答案为:球形;
(2)在d区中,族序数最大、原子序数最小的元素为Fe,常见离子为二价铁和三价铁,其离子的电子排布式为Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5,Fe3+的最外层为3d5,为半满稳定结构,而Fe2+的最外层为3d6,不是稳定结构,故Fe3+较稳定,
故答案为:Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5;Fe3+;
(3)在ds区中,原子序数最大的元素为第ⅡB族,原子的价电子排布式应为3d104s2;故答案为:3d104s2;
(4)在p区第2周期、ⅤA族元素为N,原子价电子排布为2s22p3,子价电子的轨道表示式为 ;故答案为:
;故答案为: ,
,
(5)常用于核能开发的元素是铀和钚,它们在f区中,故答案为:f.
点评 本题考查原子核外电子排布、元素周期表知识,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
1.下列变化过程中,需吸收能量的是( )
| A. | 氢氧化钠与盐酸的反应 | B. | H+Cl→HCl | ||
| C. | 氯化铵与氢氧化钡晶体反应 | D. | 金属钠与水反应 |
2.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 37Cl中的37代表该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: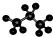 | |
| D. | 第三周期简单阴离子结构示意图均可表示为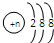 |
19.常温下,下列各溶液的叙述正确的是( )
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,则a+1=b | |
| D. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
16.1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一,下列有关我们常用的元素周期表的说法正确的是( )
| A. | ⅠA族的元素全部都是金属元素 | |
| B. | 元素周期表与18个纵行,即有18个族 | |
| C. | 同周期中的IA族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 元素周期表中右上方区域的元素多用于制造半导体材料 |
3.下列反应的离子方程式正确的是( )
| A. | 向NaOH溶液中通入过量的CO2气体:CO2+2OH-═HCO3-+H2O | |
| B. | 过量氢氧化钙与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | Fe3O4与稀硝酸反应:Fe2O3+8H+═Fe2++Fe3++4H2O | |
| D. | 偏铝酸钠溶液中加入过量盐酸:AlO2-+4H+═Al3++2H2O |
20.下列物质显示酸性,且能发生酯化反应和消去反应的是( )
| A. | 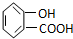 | B. | CH3CH2=CHCOOH | C. | 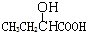 | D. | 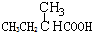 |
 化学是一门以实验为基础的学科.
化学是一门以实验为基础的学科.