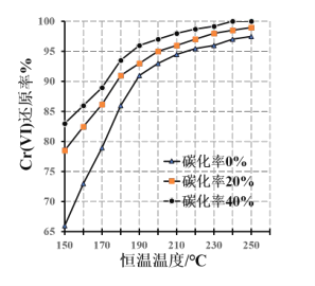
题目内容
【题目】一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是
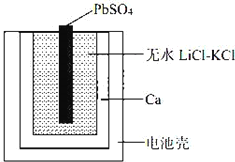
A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
【答案】C
【解析】
由原电池总反应可知Ca失电子为原电池的负极,被氧化生成CaCl2,负极的电极反应式为Ca+2Cl--2e-=CaCl2,PbSO4为原电池的正极,发生还原反应,电极反应式为PbSO4+2e-+2Li+=Li2SO4+Pb,结合原电池原理分析解答。
A.根据原电池总反应可知Ca失电子为原电池的负极,发生氧化反应,故A正确;
B.Ca为原电池的负极,被氧化生成CaCl2,电极反应式为Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s),故B正确;
C.Ca是活泼金属,能与水直接反应,所以不能用水溶液作电解质,故C错误;
D.无水LiCl﹣KCl常温为固体,不能导电,需要将无水LiCl﹣KCl混合物受热熔融,该原电池才能工作,故D正确;
答案选C。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),此电极反应式为_________。
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
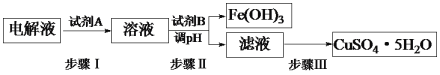
已知:几种金属阳离子开始沉淀和沉淀完全的pH。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.6 | 9.6 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
②步骤II中试剂B为_________(答出一种即可),调节pH的范围是___________;
③步骤III的操作是加热浓缩、___________、过滤。
【题目】对甲基苯乙酮是重要的化工原料,某实验小组利用如图装置制备对甲基苯乙酮。

制备原理: (放热反应)。 反应物和产物的相关数据列表:
(放热反应)。 反应物和产物的相关数据列表:
试剂名称 | 分子式 | 分子量 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 |
甲苯 | C7H8 | 92 | -93 | 110.6 | 0.8669 |
乙酸酐 | (CH3CO)2 | 102 | -73.1 | 138.6 | 1.08 |
对甲基苯乙酮 | C9H10O | 134 | 28 | 94(0.93kPa) | 1.0051 |
实验步骤:
步骤 1:如图所示,在 100mL 三颈烧瓶上安装搅拌器、仪器 x 和上口装有无水氯化钙的冷凝管,干燥管与一气体 吸收装置相连。
步骤 2:三颈烧瓶中快速加入研碎的催化剂和 20mL 无水甲苯,在搅拌的条件下通过仪器 x 缓慢地滴加 3.4mL 醋酸酐与 5mL 甲苯的混合液,约需 15min 滴完。
步骤 3:反应结束后,将三颈烧瓶在 95℃时加热 25~30min。
步骤 4:反应混合液冷却后转移到盛有 30mL 浓盐酸与 30mL 冰水的烧杯中(目的是将对甲基苯乙酮从其与铝的化 合物中分离出来),用分液漏斗分出有机层、水层。每次用 5mL 甲苯萃取两次,并将所有甲苯层合并,然后依次 用水、10%氢氧化钠溶液、水各 10mL 洗涤有机层,最后用无水硫酸镁处理。
步骤 5:将干燥后的溶液滤入蒸馏瓶,减压蒸馏(整套装置必须是干燥的),收集 94℃(0.93kPa)馏分,得到对甲 基苯乙酮 4.1g。
请回答下列问题:
(1)仪器 x 的名称为________。与普通的分液漏斗相比,本实验采用仪器 x 的优点为_______。
(2)本实验中的氯化铝若水解则会影响催化效率,除了使用干燥管的措施外,还应该采取哪些措施防止水解_____(答两点)。
(3)步骤③中最适宜的加热方式为 _____。
(4)步骤④中加入 10%的氢氧化钠溶液的目的为 _____,加入无水硫酸镁的目的为_________。
(5)步骤④中水层每次用 5mL 甲苯萃取两次并将所有甲苯层合并的目的为________。
(6)步骤⑤中减压蒸馏时所需的冷凝装置能否选用题给装置图中的球形冷能管_____(答“能”或“不能”)。 本实验中,对甲基苯乙酮的产率为_____(结果保留 2 位有效数字)。