题目内容
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠(Na2CrO4)制备氧化铬绿的工艺流程如下:
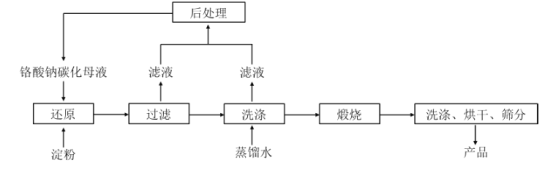
已知:①向含少量 Na2 CO3的铬酸钠碱性溶液中通入CO 2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得 Cr(OH) 3 浆料。
(1)铬酸钠(Na2CrO4)中铬元素的价态是________,该工艺中“还原”反应最初使用的是蔗糖或甲醛,请写出甲醛的电子式:________________,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式___________________________ 。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是____________(填标号)。
A.该反应一定无需加热即可进行 B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应 D.应建造废水回收池,回收含铬废水
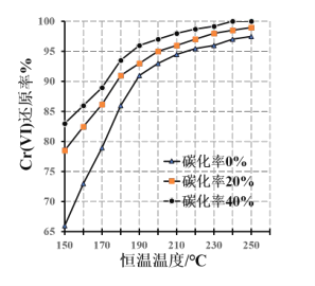
(3)测得反应完成后在不同恒温温度、不同碳化率下 Cr(Ⅵ)还原率如下图。实际生产过程中 Cr(Ⅵ)还原率可高达 99.5%以上,“还原”阶段采用的最佳反应条件为________________。
(4)滤液中所含溶质为_________________。该水热法制备氧化铬绿工艺的优点有________________ 、___(请写出两条)。
(5)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为______________________________ 。
【答案】+6  4CrO42-+3HCHO+4H2O= 4Cr(OH)3↓+3CO32-+2OH- AC 碳化率40%、恒温240℃ Na2CO3(或NaHCO3或Na2CO3、NaHCO3) 工艺清洁 原料价格低廉 Na2Cr2O7·H2O+(NH4)2SO4
4CrO42-+3HCHO+4H2O= 4Cr(OH)3↓+3CO32-+2OH- AC 碳化率40%、恒温240℃ Na2CO3(或NaHCO3或Na2CO3、NaHCO3) 工艺清洁 原料价格低廉 Na2Cr2O7·H2O+(NH4)2SO4![]() Cr2O3+N2↑+Na2SO4+5H2O。
Cr2O3+N2↑+Na2SO4+5H2O。
【解析】
(1)铬酸钠(Na2CrO4)中,Na元素的化合价为+1价,O元素的化合价为-2价,则铬元素的化合价为+6价;HCHO中,H原子最外层1个电子,C原子最外层4个电子,O原子最外层6个电子,其电子式: ,HCHO中碳元素化合价为0价,该反应在碱性环境下进行,最终生成物有碳酸钠和Cr(OH)3,根据化合价升降守恒、电荷守恒以及原子守恒可写出反应方程式;
,HCHO中碳元素化合价为0价,该反应在碱性环境下进行,最终生成物有碳酸钠和Cr(OH)3,根据化合价升降守恒、电荷守恒以及原子守恒可写出反应方程式;
(2)A.该反应虽然为放热反应,但不一定全过程都不需要加热;
B.因该反应放热剧烈,若温度过高,Cr(OH)3可能会发生分解;
C.应使淀粉适当过量,使铬酸钠充分反应;
D.铬为重金属元素,直接排放至环境中会污染水资源;
(3)由图可知,在碳化率为40%时,还原率较高,在温度为240℃时,还原率达到接近100%,再升高温度对于还原率的影响不大;
(4)由上述分析可知,滤液中所含溶质为:Na2CO3(或NaHCO3或Na2CO3、NaHCO3);水热法制备工艺的优点有:工艺清洁、原料价格低廉、设备要求低、副产物碳酸盐可用于铬酸钠碳化母液的制备、无废气废渣排放、废水可回收利用、流程短等;
(5)重铬酸钠具有强氧化性,硫酸铵具有还原性,生产过程中产生的气体对环境无害,故N元素转化为N2,二者发生氧化还原反应生成Cr2O3、N2、Na2SO4、H2O,根据氧化还原反应得失电子守恒和原子守恒写出反应方程式式。
(1)铬酸钠(Na2CrO4)中,Na元素的化合价为+1价,O元素的化合价为-2价,则铬元素的化合价为+6价,甲醛的结构式为 ,其电子式:
,其电子式: ,HCHO中碳元素化合价为0价,该反应在碱性环境下进行,最终生成物有碳酸钠和Cr(OH)3,根据化合价升降守恒、电荷守恒以及原子守恒可知其反应的离子方程式为:4CrO42-+3HCHO+4H2O= 4Cr(OH)3↓+3CO32-+2OH-,故答案为:+6;
,HCHO中碳元素化合价为0价,该反应在碱性环境下进行,最终生成物有碳酸钠和Cr(OH)3,根据化合价升降守恒、电荷守恒以及原子守恒可知其反应的离子方程式为:4CrO42-+3HCHO+4H2O= 4Cr(OH)3↓+3CO32-+2OH-,故答案为:+6; ;4CrO42-+3HCHO+4H2O= 4Cr(OH)3↓+3CO32-+2OH-;
;4CrO42-+3HCHO+4H2O= 4Cr(OH)3↓+3CO32-+2OH-;
(2)A.该反应虽然为放热反应,但不一定全过程都不需要加热,如燃烧反应为放热反应,反应开始需要加热,A错误;
B.因该反应放热剧烈,若温度过高,Cr(OH)3可能会发生分解,会影响最终产品质量,因此可在必要时可使用冷却水进行温度控制,B正确;
C.为保证原料的充分利用,应使淀粉适当过量,使铬酸钠充分反应,C错误;
D.铬为重金属元素,直接排放至环境中会污染水资源,因此应建造废水回收池,回收含铬废水,D正确;
故答案为:AC;
(3)由图可知,在碳化率为40%时,还原率较高,在温度为240℃时,还原率达到接近100%,再升高温度对于还原率的影响不大,所以最佳反应条件是碳化率40%、恒温240℃,故答案为:碳化率40%、恒温240℃;
(4)由上述分析可知,滤液中所含溶质为:Na2CO3(或NaHCO3或Na2CO3、NaHCO3);水热法制备工艺的优点有:工艺清洁、原料价格低廉、设备要求低、副产物碳酸盐可用于铬酸钠碳化母液的制备、无废气废渣排放、废水可回收利用、流程短等,故答案为:Na2CO3(或NaHCO3或Na2CO3、NaHCO3);工艺清洁、原料价格低廉、设备要求低、副产物碳酸盐可用于铬酸钠碳化母液的制备、无废气废渣排放、废水可回收利用、流程短等(任写两条);
(5)重铬酸钠具有强氧化性,硫酸铵具有还原性,生产过程中产生的气体对环境无害,故N元素转化为N2,二者发生氧化还原反应生成Cr2O3、N2、Na2SO4、H2O,根据氧化还原反应得失电子守恒和原子守恒可知该反应方程式为:Na2Cr2O7·![]() Cr2O3+N2↑+Na2SO4+5H2O,故答案为:Na2Cr2O7·H2O+(NH4)2SO4
Cr2O3+N2↑+Na2SO4+5H2O,故答案为:Na2Cr2O7·H2O+(NH4)2SO4![]() Cr2O3+N2↑+Na2SO4+5H2O。
Cr2O3+N2↑+Na2SO4+5H2O。

【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
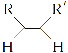
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。

②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。