题目内容
【题目】硫化氢是一种有臭鸡蛋气味的剧毒气体,在生产、生活及科研中均有重要应用。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离出H2,发生的反应为2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
已知:①H2S(g)![]() H2(8)+S(g)△H1
H2(8)+S(g)△H1
②2S(g)![]() S2(g)△H2
S2(g)△H2
则△H=________(用含△H1、△H2的式子表示)。
(2)在容积2 L的恒容密闭容器中,控制不同温度进行H2S分解:2H2S(g)![]() 2H2(g)+S2(g)。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图1所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g)。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图1所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S (g)![]() 2H2(g)+S2(g)是放热还是吸热,判断并说理由________。
2H2(g)+S2(g)是放热还是吸热,判断并说理由________。
②随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是________ 。
③在985℃时,该反应经过5 s达到平衡,则该反应的平衡常数为________。在图2中画出985℃时,0~6s 体系中S2(g)浓度随时间的变化曲线。___________________


(3)工业上常用NaOH溶液吸收H2S废气,吸收后所得溶液进行电解(装置如图3所示),在阳极区可生成Sx2-,写出生成Sx2-离子的电极反应式:________。
【答案】 2△H1+△H2 吸热反应,H2S的平衡转化率随温度的升高而逐渐增大 温度升高,反应速率加快,达到平衡所需时间缩短 0.044 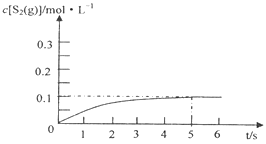 xS2--2(x-1)e-=Sx2-或[S2--2e-=S↓,(x-1)S+S2-=Sx2-
xS2--2(x-1)e-=Sx2-或[S2--2e-=S↓,(x-1)S+S2-=Sx2-
【解析】(1)本题考查热化学反应方程式的计算,①×2-②得出△H=2△H1-△H2;(2)本题考查勒夏特列原理、影响化学反应速率的因素、化学平衡常数的计算,①根据图像,随着温度的升高,H2S的转化率增大,根据勒夏特列原理,正反应为吸热反应;②温度升高,化学反应速率加快,达到平衡所用时间缩短;③2H2S(g)![]() 2H2(g)+S2(g)
2H2(g)+S2(g)
起始: 1 0 0
变化:0.4 0.4 0.2
平衡:0.6 0.4 0.2 根据化学平衡常数的表达式K=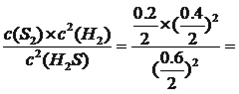 0.044;S2的物质的量随着时间增加而增加,在5s达到平衡,此时S2的浓度为0.2/2mol·L-1=0.1mol·L-1,即图像为
0.044;S2的物质的量随着时间增加而增加,在5s达到平衡,此时S2的浓度为0.2/2mol·L-1=0.1mol·L-1,即图像为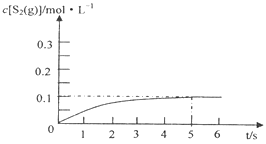 ;(3)本题考查电极反应式的书写,根据图3,电极b产生氢气,电极反应式为2H++2e-=H2↑,电极b为阴极,电极a为阳极,阳极上产生Sx2-,电极a电极反应式为xS2--2(x-1)e-=Sx2-。
;(3)本题考查电极反应式的书写,根据图3,电极b产生氢气,电极反应式为2H++2e-=H2↑,电极b为阴极,电极a为阳极,阳极上产生Sx2-,电极a电极反应式为xS2--2(x-1)e-=Sx2-。

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,体积均为0.25 L的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,达到平衡。下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,达到平衡。下列说法正确的是( )
容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
N2 | H2 | NH3 | NH3 | ||
① | 500 | 1 | 3 | 0 | 0.5 |
② | 500 | 0.6 | 1.8 | 0 | |
③ | 550 | 0 | 0 | 2 | a |
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,容器②中H2的转化率大于25%
C. a<0.5
D. 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行