题目内容
【题目】科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2 和H2反应生成乙烯和水蒸气的热化学方程式为____________,上述反应在__________下自发进行(填“高温”或“低温”)。
(2)乙烯是一种重要的气体燃料,可与氧气、熔融碳酸钠组成燃料电池。写出该燃料电池负极的电极反应式:_______________________.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。
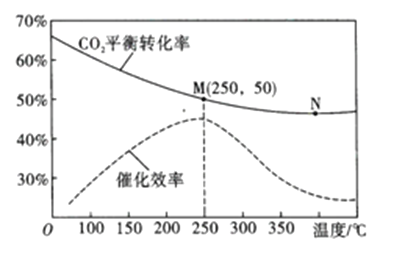
①平衡常数: KM__________KN (填“>”“<”或“=”)。
②下列说法正确的是_________(填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或n(H2)/n(CO2)不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________。
(5)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______(填“增大”“减小”或“不变”)。
【答案】 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol 低温 C2H4-12e-+6CO32-=8CO2+2H2O > D c(Na+)>c(CO32-)>c(HCO3-)>c(H+) 14%或0.14 逆向 减小
C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol 低温 C2H4-12e-+6CO32-=8CO2+2H2O > D c(Na+)>c(CO32-)>c(HCO3-)>c(H+) 14%或0.14 逆向 减小
【解析】(1).根据题给信息分别写出三个热化学反应方程式:H2O(g)=H2O(l)ΔH=-44.0kJ/mol,C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H=-1411.0kJ·mol- ,H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol;根据盖斯定律,整理出热化学方程式并计算出反应的ΔH;正确答案:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;该反应为一个S<0,ΔH<0的反应,在低温下能够进行;正确答案:低温;
C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;该反应为一个S<0,ΔH<0的反应,在低温下能够进行;正确答案:低温;
(2)乙烯气体与氧气形成的燃料电池,电解质为熔融碳酸钠;乙烯做负极被氧化生成二氧化碳;根据电子守恒和电荷守恒规律,极反应为: C2H4-12e-+6CO32-=8CO2+2H2O;正确答案:C2H4-12e-+6CO32-=8CO2+2H2O;
(3从图像看出,温度升高,二氧化碳的转化率降低,该反应正反应为放热反应;升高温度,平衡左移,平衡常数减小;
①正确答案:KM >KN;
② 可逆反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;其他条件下不变,反应前后的气体的总质量不变,容器的体积不变,混合气体密度恒为定值,无法判定平衡状态,A错误;该反应为反应前后气体总量减少的反应,压强不变可以判定反应达平衡状态,但是氢气、二氧化碳均为反应物,按一定比例关系进行反应,n(H2)/n(CO2)始终保持不变,无法判定平衡状态, B错误;温度高于250℃时,催化剂的催化效率降低,但是催化剂对平衡的移动无影响,向左移动是因为温度升高的缘故;C错误;该反应为气体体积减少的的反应,若将容器由“恒容”换为“恒压”,其他条件不变,相当于加压的过程,平衡右移,CO2的平衡转化率增大,D正确;正确答案:D;
C2H4(g)+4H2O(g) ΔH=-127.8kJ/mol;其他条件下不变,反应前后的气体的总质量不变,容器的体积不变,混合气体密度恒为定值,无法判定平衡状态,A错误;该反应为反应前后气体总量减少的反应,压强不变可以判定反应达平衡状态,但是氢气、二氧化碳均为反应物,按一定比例关系进行反应,n(H2)/n(CO2)始终保持不变,无法判定平衡状态, B错误;温度高于250℃时,催化剂的催化效率降低,但是催化剂对平衡的移动无影响,向左移动是因为温度升高的缘故;C错误;该反应为气体体积减少的的反应,若将容器由“恒容”换为“恒压”,其他条件不变,相当于加压的过程,平衡右移,CO2的平衡转化率增大,D正确;正确答案:D;
③250℃时,根据图像看出,二氧化碳的转化率为50%,平衡后剩余二氧化碳的量1×50%=0.5mol,设反应生成碳酸氢钠xmol,碳酸钠y mol,根据碳原子守恒:x+y=0.5;根据钠离子守恒:x+2y=3×0.3,解之,x= 0.1mol ,y=0.4mol;即碳酸氢钠0.1mol,碳酸钠 0.4mol, 碳酸钠的量比碳酸氢钠大,CO32-水解很少,剩余得多;所以c(CO32-)>c(HCO3-);溶液中离子浓度大小关系:c(Na+)>c(CO32-)>c(HCO3-)>c(H+);正确答案:c(Na+)>c(CO32-)>c(HCO3-)>c(H+);
④可逆反应: 2CO2(g)+6H2(g)![]() C2H4(g) + 4H2O(g)
C2H4(g) + 4H2O(g)
起始量:1 3 0 0
变化量 1×50% 3×50% 0.5×50% 2×50%
平衡量 0.5 1.5 0.25 1
混合气体的总质量:1×44+3×2=50g, 乙烯的质量:0.25×28=7 g,所以乙烯的质量分数为7÷50×100%= 14%或0.14;正确答案:14%或0.14;
(5)增大体积,相当于减压,平衡向左移动;正确答案:逆向;反应前后混合气体的总质量不变,体积变大,所以密度减少;正确答案:减小;

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究:
实验一:检验氢氧化钠溶液中是否含有氢氧化钙。
(分析)从组成上看,氢氧化钙和氢氧化钠都属于碱,它们在水溶液中都能解离出相同的_______(填符号),所以具有相似的化学性质。但由于解离出的Na+和Ca2+不同,所以性质也有不同。设计实验时可加入能解离出CO32﹣的试剂利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验。
(设计方案并实验)
实验操作 | 现象 | 结论 | |
方案一 | 取少量待测溶液于试管中,通入CO2 | 出现白色沉淀 | 氢氧化钠溶液中含有氢氧化钙 |
方案二 | 取少量待测溶液于试管中,滴加 _________溶液 | 出现白色沉淀 |
写出上述方案中出现白色沉淀的一个化学方程式__________________________________________。
(方法感悟)在检验物质时,要分析物质的组成和______。据此选择加入恰当的试剂,最后根据不同现象得出结论。
(实验探究)实验二:有一包白色固体,可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种,为探究其组成,某合作学习小组设计方案并进行了如下实验:

(1)上述实验中,过滤操作用到的玻璃仪器有:烧杯、玻璃棒和_________。
(2)小晶同学通过上述实验推知:白色固体样品中一定不含有_________。(填化学式)
(3)为确定白色固体样品中可能存在的物质,小燕对沉淀C进行实验。
实验操作 | 现象 | 结论 |
取少量沉淀C于试管中,加入过量 _________。 | 有气泡产生,沉淀全部消失。 | 白色固体样品中一定含有 ________。 |
(4)小虎同学认为白色固体中还要物质不能确认其是否存在.其理由是:_________________。
(用化学方程式表示)如要确认,只需将上述实验方案中所加的一种试剂改为_______即可。
(方法感悟)若其他物质的存在对所检验的物质有干扰时,可先将干扰物质转化,再选择加入恰当的试剂,最后根据不同现象得出结论。