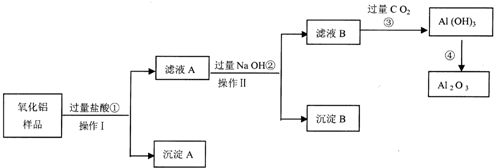
题目内容
10.镍-镉可充电电池可发生如下反应:Cd(OH)2$?_{放电}^{充电}$+2Ni(OH)2充电放电Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是( )| A. | Cd | B. | NiO(OH) | C. | Cd(OH)2 | D. | Ni(OH)2 |
分析 根据总反应式结合化合价的变化判断被氧化和被还原的物质,原电池中负极发生氧化反应.
解答 解:Cd(OH)2+2Ni(OH)2$?_{放电}^{充电}$Cd+2NiO(OH)+2H2O,由方程式可知,Cd元素化合价升高,被氧化,在原电池负极上发生氧化反应,则Cd为原电池的负极,
故选A.
点评 本题考查原电池反应,题目难度不大,注意根据化合价的变化判断原电池的正负极反应.

练习册系列答案
相关题目
20.2011年“国际化学年”的主题是“化学,我们的生活,我们的未来”.下列行为中不符合这一主题的是( )
| A. | 用CO2合成可降解塑料,实现碳的循环利用 | |
| B. | 提倡使用太阳能、潮汐能、风能等清洁能源,减少化石燃料的使用 | |
| C. | 提高煤炭和石油的产量,以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
1.在PCl5(g)?PCl3(g)+Cl2(g),达到平衡后,其它条件不变,向平衡体系中加入37Cl2,达到新平衡后,含37Cl的PCl3的物质的量与原平衡相比( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
15.在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)?PCl5(g);5min末达到平衡,有关数据如表.
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 若升高温度,反应的平衡常数减小,则正反应为吸热反应 | |
| B. | 反应5 min内,v(PCl3)=0.08 mol•L-1•min-1 | |
| C. | 当容器中为1.2 mol Cl2时,可逆反应达到平衡状态 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
6.取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4,B容器中充入0.2molHI气体,在一定温度下反应分别达到平衡,测得N2O4和HI的分解率分别为a(A)和a(B).在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为a′(A)和a′(B).下列判断一定正确的是( )
| A. | a(A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a(B)=a′(B) | C. | a(A)<a′(A) a(B)<a′(B) | D. | a(A)=a′(A) a(B)>a′(B) |

 .
.