题目内容
1.在PCl5(g)?PCl3(g)+Cl2(g),达到平衡后,其它条件不变,向平衡体系中加入37Cl2,达到新平衡后,含37Cl的PCl3的物质的量与原平衡相比( )| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
分析 向容器中充入一定量的37Cl2,达新平衡后,37Cl会存在PCl3中,据此分析.
解答 解:向容器中充入一定量的37Cl2,达新平衡后,37Cl会存在PCl3中,所以含37Cl的PCl3的物质的量与原平衡相比增大,故A正确;
故选A.
点评 本题考查化学平衡的影响元素,难度不大,注意可逆反应加入37Cl2,37Cl会存在PCl3、PCl5、Cl2中.

练习册系列答案
相关题目
12.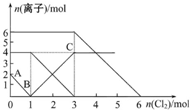 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )| A. | 离子的还原性顺序为:Fe2+>I->Br- | |
| B. | 原混合溶液中FeBr2的物质的量为4mol | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=1:2:3 | |
| D. | 当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
9.能区别硝酸银、盐酸、氢氧化钾三种溶液的一种试剂是( )
| A. | MgCl2溶液 | B. | FeCl3溶液 | C. | NaNO3溶液 | D. | K2SO4溶液 |
16.下列事实对应的离子方程式书写正确的是( )
| A. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 纯碱溶液能清洗油污:CO32-+2H2O?H2CO3+2OH- | |
| D. | 将过量的铁粉加入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O |
6.100mL Fe2(SO4)3溶液中含有SO42-0.3mol,取25mL溶液稀释到125mL,则稀释后溶液中Fe3+的物质的量浓度是( )
| A. | 0.2 mol/L | B. | 0.3 mol/L | C. | 0.4 mol/L | D. | 0.6 mol/L |
10.镍-镉可充电电池可发生如下反应:Cd(OH)2$?_{放电}^{充电}$+2Ni(OH)2充电放电Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是( )
| A. | Cd | B. | NiO(OH) | C. | Cd(OH)2 | D. | Ni(OH)2 |
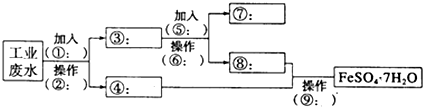
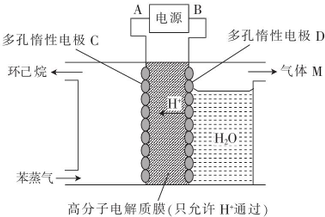 氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越,安全性高、价格低廉、环保的储氢
氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越,安全性高、价格低廉、环保的储氢
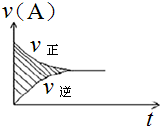 可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.
可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.