题目内容
2.短周期主族元素A、B、C、D、E原子序数依次增大,C在短周期主族元素中原子半径最大;A与C,B与D 分别位于同一主族,且B与D原子序数之和恰好是 A与C原子序数之和的2倍.请回答下列问题:(1)D元素在元素周期表中的位置第三周期ⅥA族.
(2)C2B2的电子式为
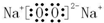 .
.(3)B、C、D、E所形成简单离子的半径由大到小的顺序是S2->Cl->O2->Na+(填离子符号).
(4)实验室欲检验CE溶液中所含的E-,操作方法和现象为取少量溶液于试管中,先加稀硝酸酸化再加硝酸银,若有白色沉淀产生,则证明有氯离子.
(5)Cu不与稀硫酸反应,但将Cu投入稀硫酸与A2B2的混合溶液,溶液变蓝,写出其离子反应方程式Cu+2H++H2O2=Cu2++2H2O.
分析 短周期主族元素A、B、C、D、E原子序数依次增大,C在短周期主族元素中原子半径最大,则C为Na;A、C同主族,A、C原子序数之和为12或13,E的原子序数最大,B与D 分别位于同一主族,二者原子序数之和小于9+19=26,且B与D原子序数之和恰好是 A与C原子序数之和的2倍,则A、C原子序数之和为12,故A为H元素,B为O元素,D为S元素,E为Cl,据此解答.
解答 解:短周期主族元素A、B、C、D、E原子序数依次增大,C在短周期主族元素中原子半径最大,则C为Na;A、C同主族,A、C原子序数之和为12或13,E的原子序数最大,B与D 分别位于同一主族,二者原子序数之和小于9+19=26,且B与D原子序数之和恰好是 A与C原子序数之和的2倍,则A、C原子序数之和为12,故A为H元素,B为O元素,D为S元素,E为Cl.
(1)D为硫元素,处于周期表中第三周期ⅥA族,故答案为:第三周期ⅥA族;
(2)Na2O2的电子式为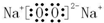 ,故答案为:
,故答案为: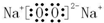 ;
;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2->Cl->O2->Na+,故答案为:S2->Cl->O2->Na+;
(4)实验室欲检验NaCl溶液中所含的Cl-,操作方法和现象为:取少量溶液于试管中,先加稀硝酸酸化再加硝酸银,若有白色沉淀产生,则证明有氯离子,
故答案为:取少量溶液于试管中,先加稀硝酸酸化再加硝酸银,若有白色沉淀产生,则证明有氯离子;
(5)Cu不与稀硫酸反应,但将Cu投入稀硫酸与H2O2的混合溶液,溶液变蓝,其离子反应方程式为:Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O.
点评 本题考查位置结构与性质的关系及应用,推断元素的为解答的关键,侧重分析与推断能力及元素化合物知识的考查,题目难度不大.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案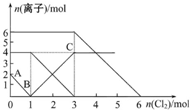 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )| A. | 离子的还原性顺序为:Fe2+>I->Br- | |
| B. | 原混合溶液中FeBr2的物质的量为4mol | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=1:2:3 | |
| D. | 当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| A. | Cd | B. | NiO(OH) | C. | Cd(OH)2 | D. | Ni(OH)2 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
| A. | 0.4mol | B. | 0.2mol | C. | 0.2mol<x<0.4mol | D. | <0.2mol |
| 选项 | 实验目的 | 实验方案 |
| A | 验证Br2的氧化性强于l2 | 将少量溴水加入Kl溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| B | 探究石蜡油分解的产物含有烯烃 | 将石蜡油加强热产生的气体通入溴的四氧化碳溶液中 |
| C | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水溶加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| D | 验证Na能置换出醇烃基中的氢 | 向一定量的无水乙醇中加入足量Na,测量生成气体的体积 |
| A. | A | B. | B | C. | C | D. | D |
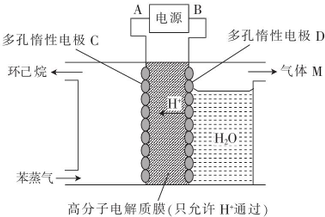 氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越,安全性高、价格低廉、环保的储氢
氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越,安全性高、价格低廉、环保的储氢
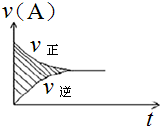 可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.
可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.