题目内容
15.在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)?PCl5(g);5min末达到平衡,有关数据如表.| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 若升高温度,反应的平衡常数减小,则正反应为吸热反应 | |
| B. | 反应5 min内,v(PCl3)=0.08 mol•L-1•min-1 | |
| C. | 当容器中为1.2 mol Cl2时,可逆反应达到平衡状态 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
分析 A、若升高温度,反应的平衡常数减小,平衡逆向移动,则正反应为放热反应;
B、根据v=$\frac{△c}{t}$求得PCl5的速率,利用速率之比等于计量数之比求得PCl3的速率;
C、平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,根据△n=△c×V计算△n(Cl2),进而计算平衡时Cl2的物质的量;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,据此判断.
解答 解:A、若升高温度,反应的平衡常数减小,平衡逆向移动,则正反应为放热反应,故A错误;
B、根据v=$\frac{△c}{t}$求得PCl5的速率为$\frac{0.4}{5}$mol•L-1•min-1=0.08mol•L-1•min-1,利用速率之比等于计量数之比求得PCl3的速率为0.08mol•L-1•min-1,故B正确;
C、平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,△n(Cl2)=0.4mol/L×2L=0.8mol,故平衡时Cl2的物质的量为1mol/L×2L-0.8mol=1.2mol,故C正确;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,故D正确;
故选A.
点评 本题考查化学平衡常数的应用、化学平衡的有关计算等,难度中等,注意D选项中构建平衡建立的途径.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
6.100mL Fe2(SO4)3溶液中含有SO42-0.3mol,取25mL溶液稀释到125mL,则稀释后溶液中Fe3+的物质的量浓度是( )
| A. | 0.2 mol/L | B. | 0.3 mol/L | C. | 0.4 mol/L | D. | 0.6 mol/L |
3.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述中,不正确的是( )
| A. | 分子中碳原子不在一条直线上 | B. | 光照不能够发生取代反应 | ||
| C. | 是石油分馏的一种产品 | D. | 比丁烷更易液化 |
10.镍-镉可充电电池可发生如下反应:Cd(OH)2$?_{放电}^{充电}$+2Ni(OH)2充电放电Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是( )
| A. | Cd | B. | NiO(OH) | C. | Cd(OH)2 | D. | Ni(OH)2 |
11.现有几组物质的熔点数据如下表:
据此回答下列问题:
(1)A组属于原子晶体晶体,其熔化时克服的微粒间的作用力是共价键;
(2)B组晶体共同的物理性质是①②③④(填序号);①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于HF分子间存在氢键;
(4)D组晶体可能具有的性质是②④(填序号);①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
| A组 | B组 | C组 | D组 |
| 金刚石:3110℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-114℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
(1)A组属于原子晶体晶体,其熔化时克服的微粒间的作用力是共价键;
(2)B组晶体共同的物理性质是①②③④(填序号);①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于HF分子间存在氢键;
(4)D组晶体可能具有的性质是②④(填序号);①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
12.已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )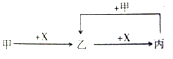

| A. | 甲为C,X为O2 | B. | 甲为Fe,X为Cl2 | ||
| C. | 甲为CO2,X为NaOH溶液 | D. | 甲为HCl,X为Na2CO3溶液 |