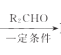
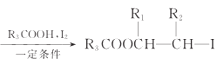题目内容
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B |
|
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)![]() 原子的核外电子排布式:___________________。
原子的核外电子排布式:___________________。
(2)![]() 元素在元素周期表中的位置________;离子半径:
元素在元素周期表中的位置________;离子半径:![]() ____
____![]() (填“大于”或“小于”)
(填“大于”或“小于”)
(3)![]() 原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
(4)![]() 的结构示意图是________________。
的结构示意图是________________。
(5)![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的最高价氧化物对应的水化物反应的化学方程式为________,与
的最高价氧化物对应的水化物反应的化学方程式为________,与![]() 最高价氧化物对应的水化物反应的化学方程式为________________。
最高价氧化物对应的水化物反应的化学方程式为________________。
(6)举一实例说明![]() 元素的非金属性比
元素的非金属性比![]() 元素的强_______________
元素的强_______________
【答案】![]() 第三周期第IIIA族 小于
第三周期第IIIA族 小于 ![]() 2p 哑铃
2p 哑铃 
![]()
![]() 高氯酸的酸性强于硝酸
高氯酸的酸性强于硝酸
【解析】
根据表格分析,短周期元素半径最大的原子是钠,则A是Na,![]() 与
与![]() 同周期,其最高价氧化物的水化物呈两性,则B是Al,C元素的气态氢化物极易溶于水,可用作制冷剂,则C是N,D质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D是Cl。
同周期,其最高价氧化物的水化物呈两性,则B是Al,C元素的气态氢化物极易溶于水,可用作制冷剂,则C是N,D质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D是Cl。
(1)![]() 原子(11号)的核外电子排布式:
原子(11号)的核外电子排布式:![]() ;
;
(2)![]() 元素是Al,位于元素周期表第三周期第IIIA族;离子的电子结构相同,则序数越大,质子与电子的吸引力越强,半径越小,故离子半径:
元素是Al,位于元素周期表第三周期第IIIA族;离子的电子结构相同,则序数越大,质子与电子的吸引力越强,半径越小,故离子半径:![]() 小于
小于![]() ;
;
(3)![]() 原子(N)的电子排布图是:
原子(N)的电子排布图是:![]() ,电子的排布遵守能量最低原理,故2p轨道上的电子能量最高,s级的形状是球形,p能级的形状是哑铃形;
,电子的排布遵守能量最低原理,故2p轨道上的电子能量最高,s级的形状是球形,p能级的形状是哑铃形;
(4)![]() (Cl)的结构示意图是:
(Cl)的结构示意图是: ;
;
(5)![]() 具有两性,能溶于强酸和强碱;
具有两性,能溶于强酸和强碱;![]() 的最高价氧化物对应的水化物(
的最高价氧化物对应的水化物(![]() )与
)与![]() 的最高价氧化物对应的水化物(
的最高价氧化物对应的水化物(![]() )反应的化学方程式为:
)反应的化学方程式为:![]() ;
;![]()
![]() 最高价氧化物对应的水化物(
最高价氧化物对应的水化物(![]() )反应的化学方程式为
)反应的化学方程式为![]() ;
;
(6)元素的非金属性越强,则最高价氧化物对应的水化物酸性越强,故高氯酸的酸性强于硝酸,能说明氯的非金属性强于氮。

 名校课堂系列答案
名校课堂系列答案【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定