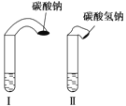
题目内容
【题目】用0.1000 mol·L1 NaOH溶液滴定20.00 mL 0.1000 mol·L1的H3A溶液的滴定曲线如图所示。己知H3A的pKa1、pKa2、pKa3分别为2、7和12(pKa=-lgKa),下列说法正确的是
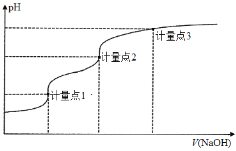
A.滴定前溶液pH值约为3
B.计量点1时,可以用甲基橙作为指示剂
C.到达计量点2时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达计量点3时,微热溶液,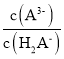 会增大
会增大
【答案】B
【解析】
A.已知pKa1=2,则lgKa1=-2,Ka1=10-2,由H3A![]() H2A-+H+可知,未滴定前,Ka1=
H2A-+H+可知,未滴定前,Ka1=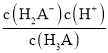 ,则c(H+)=(10-1×10-2)=10-1.5,故A错误;
,则c(H+)=(10-1×10-2)=10-1.5,故A错误;
B.第一个计量点好完全反应生成NaH2A,此时溶液中H2A-的水解常数Kh=![]() =
=![]() =10-10<10-7,则H2A-的电离程度大于H2A-的水解程度,溶液显酸性,则不能使用酚酞作指示剂,而选择甲基橙作指示剂,故B正确;
=10-10<10-7,则H2A-的电离程度大于H2A-的水解程度,溶液显酸性,则不能使用酚酞作指示剂,而选择甲基橙作指示剂,故B正确;
C.到达计量点2时,恰好生成Na2HA,此时溶液中的HA2-的水解常数Kh2=![]() =
=![]() =10-7>10-12,所以,HA2-的电离程度小于HA2-的水解程度,溶液显碱性,由溶液中的电荷守恒c(Na+)+c(H+)=c(H2A-)+2c(HA2-)+3c(A3-)+ c(OH-),所以,溶液中存在c(Na+)>c(H2A-)+2c(HA2-)+3c(A3-),故C错误;
=10-7>10-12,所以,HA2-的电离程度小于HA2-的水解程度,溶液显碱性,由溶液中的电荷守恒c(Na+)+c(H+)=c(H2A-)+2c(HA2-)+3c(A3-)+ c(OH-),所以,溶液中存在c(Na+)>c(H2A-)+2c(HA2-)+3c(A3-),故C错误;
D.到达计量点3时,恰好生成Na3A,此时溶液中存在A3-的三级水解,且加热促进水解,即加热过程中c(A3-)减小,c(H2A-)增大,则![]() 会减小,故D错误。
会减小,故D错误。
答案选B。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B |
|
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)![]() 原子的核外电子排布式:___________________。
原子的核外电子排布式:___________________。
(2)![]() 元素在元素周期表中的位置________;离子半径:
元素在元素周期表中的位置________;离子半径:![]() ____
____![]() (填“大于”或“小于”)
(填“大于”或“小于”)
(3)![]() 原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
(4)![]() 的结构示意图是________________。
的结构示意图是________________。
(5)![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的最高价氧化物对应的水化物反应的化学方程式为________,与
的最高价氧化物对应的水化物反应的化学方程式为________,与![]() 最高价氧化物对应的水化物反应的化学方程式为________________。
最高价氧化物对应的水化物反应的化学方程式为________________。
(6)举一实例说明![]() 元素的非金属性比
元素的非金属性比![]() 元素的强_______________
元素的强_______________