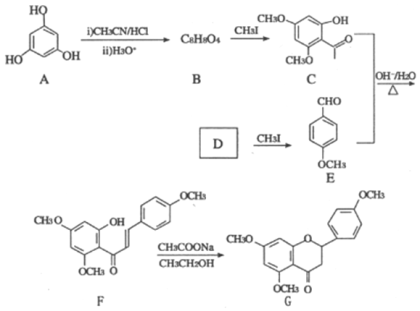
题目内容
【题目】
铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________.
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有:_____________。
(3)现代工业冶金中,2Au(CN)2-+Zn====2Au+Zn(CN)42-。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如 CH3CH2OH ![]() CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
(5)一种铜镍合金(俗称白铜)的晶胞如图1所示,铜、镍原子个数比为___________。

(6)金晶胞如图2所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(![]() )为___________ (用π含的式子表示),(提示原子空间利用率=
)为___________ (用π含的式子表示),(提示原子空间利用率=![]() )
)
【答案】3d104s1 平面三角形 2 sp3 H3O+ C的电负性比N小,吸引孤电子对的能力比N弱 乙醇分子间形成氢键 s-s 3:1 面心立方最密 ![]()
【解析】
(1)铜原子有29个电子,电子排布要遵循洪特规则的特例。
(2)①NO3-形成3个σ键,或价层电子对为3+(6-2×3)/2=3;
②配位数等于配位原子个数,NH3中N原子是配位原子;[Ag(NH3)2]+中银离子的配位数为2;NH3分子中N的杂化类型是sp3杂化。
③等电子体原子个数和价电子总数相同。
(3)提供孤电子对形成配位键具备两个条件,一是有孤电子对,二是配位原子的电负性不能太大;
(4)CH3CH2OH的沸点高于CH3CHO的主要原因是CH3CH2OH的分子间形成氢键;从原子轨道重叠方式分类,H2分子中σ键类型是s-s键。
(5)用均摊法分析;
(6)利用公式原子空间利用率=![]()
(1)铜原子有29个电子,电子排布要遵循洪特规则的特例。基态铜原子的价层电子排布式为3d104s1;
(2)①NO3-形成3个σ键,或价层电子对为3+(6-2×3)/2=3,故空间构型为平面三角形。
②配位数等于配位原子个数,NH3中N原子是配位原子;[Ag(NH3)2]+中银离子的配位数为2;NH3分子中N的杂化类型是sp3杂化。
③等电子体原子个数和价电子总数相同,与NH3互为等电子体的离子有:H3O+。
(3)提供孤电子对形成配位键具备两个条件,一是有孤电子对,二是配位原子的电负性不能太大,如CO、CN-等配体中C提供孤电子对,因为C的电负性比N、O的小。
(4)H2中H与H原子只有σs-s键。
(5)面心立方中,顶点贡献率为1/8,面心贡献率为1/4,一个晶胞含3个铜原子、1个镍原子,因此铜、镍原子个数比为3:1。
(6)设金原子半径为r,晶胞参数为a。面心立方晶胞中,面对角线上3个金原子相切,有:(4r)2=2a2,r=![]() a,1个金晶胞含4个金原子,
a,1个金晶胞含4个金原子,![]() =
=![]()

 小学课时特训系列答案
小学课时特训系列答案