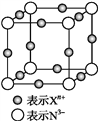
题目内容
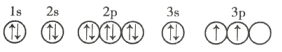
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
【答案】氯 Cu2+的价电子排布式为3d9,Cu+的价电子排布式为3d10,3d能级上电子全满时较稳定,则Cu2O的稳定性强于CuO N>O>S ![]() S2->N3->F- O>N>C>H
S2->N3->F- O>N>C>H
【解析】
由X元素原子中没有成对电子可判断X为H元素;由Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,可得Y的核外电子排布式为![]() ,则Y为C元素;由Z元素原子的价电子排布式为
,则Y为C元素;由Z元素原子的价电子排布式为![]() ,可判断n=2,Z为N元素;再根据Q元素基态原子核外成对电子数是未成对电子数的3倍,可得Q的核外电子排布式为
,可判断n=2,Z为N元素;再根据Q元素基态原子核外成对电子数是未成对电子数的3倍,可得Q的核外电子排布式为![]() ,则Q为O元素;由于Q位于同周期且E的原子序数比Q的原子序数大可知E为F元素;根据M元素的第一电离能在同周期主族元素中排第三位,且X、Y、Z、O、K、M、G原子序数依次增大,可确定M为S元素;由G元素原子的价电子排布式为
,则Q为O元素;由于Q位于同周期且E的原子序数比Q的原子序数大可知E为F元素;根据M元素的第一电离能在同周期主族元素中排第三位,且X、Y、Z、O、K、M、G原子序数依次增大,可确定M为S元素;由G元素原子的价电子排布式为![]() 可知G为Cu元素。
可知G为Cu元素。
(1)第3周期基态原子未成对电子数与G的相同且电负性最大的元素是氯,Cu2+的价电子排式为3d9,Cu+的价电子排布式为3d10,3d能级上电子全满时较稳定,所以Cu2O的稳定性强于CuO;
(2)N原子2p轨道半充满,能量低,因而第一电离能大于同周期相邻的O原子,又在同主族时,自下而上第一电离能越大,所以O原子的第一电离能大于S原子的第一电离能,故N>O>S;
(3)Y与Q形成原子个数比为1:2的化合物为CO2,电子式为![]() ;
;
(4)电子层数越多,离子半径越大;核外电子排布相同时,原子序数越大,离子半径越小,则Z、M、E所形成的简单离子的半径由大到小的顺序为S2->N3->F-;
(5)H原子的电负性最小,又同周期时,从左往右电负性越来越大,故O>N>C>H。

【题目】下表为元素周期表前四周期的一部分,下列有关X、Y、Z、R、W五种元素的叙述中,错误的是
X | ||||
Y | Z | |||
R | W |
A.常压下五种元素的单质中,Y的沸点最高
B.元素电负性:X>Z>Y
C.基态原子中未成对电子数最多的是R
D.元素最高价氧化物对应的水化物酸性:W>Z>Y