题目内容
【题目】下列推论错误的是
A.NaCl为离子晶体,可推测CsCl也为离子晶体
B.CO2晶体是分子晶体,可推测CS2晶体也是分子晶体
C.NH4+为正四面体结构,可推测PH4+也为正四面体结构
D.NCl3中N原子是sp3杂化,可推测BCl3中B原子也是sp3杂化
【答案】D
【解析】
A.Cs和Na均为活泼金属元素,与Cl形成离子键,所以NaCl、CsCl均是离子晶体,A正确;
B.CO2晶体由分子间作用力结合而成, CS2晶体也是由分子间作用力结合而成,都是分子晶体,B正确;
C.N、P为同主族元素,NH4+ 和PH4+中,中心N、P原子孤对电子数=![]() =0,σ键电子对数=
=0,σ键电子对数=![]() =4,价层电子对数=4+0=4,所以NH4+ 和PH4+中心原子皆为sp3杂化,空间构型均是正四面体,C正确;
=4,价层电子对数=4+0=4,所以NH4+ 和PH4+中心原子皆为sp3杂化,空间构型均是正四面体,C正确;
D.NCl3中N原子孤对电子数=![]() =1,σ键电子对数=
=1,σ键电子对数=![]() =3,价电子对数=3+1=4,所以NCl3中N原子是sp3杂化,BCl3中B原子孤对电子数=
=3,价电子对数=3+1=4,所以NCl3中N原子是sp3杂化,BCl3中B原子孤对电子数=![]() =0,σ键电子对数=
=0,σ键电子对数=![]() =3,价层电子对数=3+0=3,所以BCl3中B原子是sp2杂化,D错误。
=3,价层电子对数=3+0=3,所以BCl3中B原子是sp2杂化,D错误。
答案选D。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
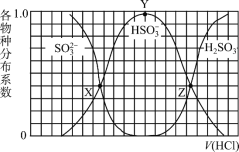
综合自测系列答案【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
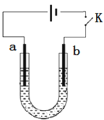
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法正确的是( )
A.a为石墨,b为铁钉
B.阴极主要发生反应 4OH--4e-== O2↑+ 2H2O
C.高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体