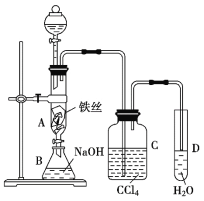
题目内容
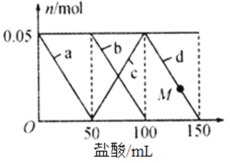
【题目】25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa = –lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21.下列有关说法错误的是
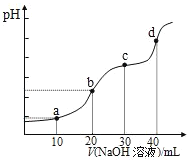
A.H2R + R22HR平衡常数K>105,反应趋于完全
B.常温下,Kh(HR-)的数量级为10-13
C.点b时,pH<7且 c(R2)·c(H+)<c(H2R)·c(OH)
D.点c时,溶液中2c(OH)-2c(H+)=3c(H2R)+ c(HR)-c(R2)
【答案】C
【解析】
A.pKa = –lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21,Ka1= =10-1.89,Ka2=
=10-1.89,Ka2=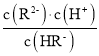 =10-7.21,H2R + R22HR平衡常数K=
=10-7.21,H2R + R22HR平衡常数K=![]() =
=![]() =105.32>105, K越大,表示反应正向进行的程度越大,则反应趋于完全,故A正确;
=105.32>105, K越大,表示反应正向进行的程度越大,则反应趋于完全,故A正确;
B.常温下,Kh(HR-)=![]() =10-12.11,则Kh(HR-)数量级为10-13,故B正确;
=10-12.11,则Kh(HR-)数量级为10-13,故B正确;
C.b点二者恰好完全反应生成NaHR,Ka1=107.21>Kh=![]() ,溶液呈酸性,即pH <7,且
,溶液呈酸性,即pH <7,且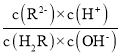 =
=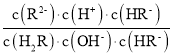 =
=![]() =
=![]() =104.9>1,即c(R2)·c(H+)>c(H2R)·c(OH),故C错误;
=104.9>1,即c(R2)·c(H+)>c(H2R)·c(OH),故C错误;
D.c点溶液溶质为等物质的量的Na2R、NaHR,Na2R溶液中存在质子守恒:c(OH)= c(HR)+2c(H2R)+ c(H+),NaHR溶液中存在质子守恒:c(OH)+ c(R2)= c(H2R)+ c(H+),两个溶液混合后,两式合并,质子守恒式为:2c(OH)+c(R2)=3c(H2R)+ c(HR)+2c(H+),则2c(OH)-2c(H+)=3c(H2R)+ c(HR)-c(R2),故D正确;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应