题目内容
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
Ⅰ.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1①
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
已知:H2和CH4的燃烧热分别为285.5 kJ·mol-1和890.0 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1。
(1)ΔH1=________ kJ·mol-1。
(2)有利于提高CH4产率的反应条件是(至少写两条)______________________________工业上提高甲烷反应选择性的关键因素是________________________________。
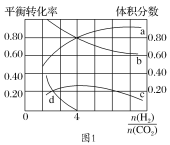
(3)T℃时,若在体积恒为2 L的密闭容器中同时发生上述反应,将物质的量之和为5 mol的H2和CO2以不同的投料比进行反应,结果如图1所示。若a、b表示反应物的平衡转化率,则表示H2平衡转化率的是________,c、d分别表示CH4(g)和CO(g)的体积分数,由图1可知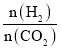 =________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
=________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
Ⅱ.溶于海水的CO2 95%以HCO3-形式存在。
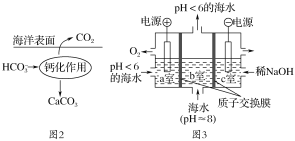
在海洋中,通过图2钙化作用实现碳自净。
(4)写出钙化作用的离子方程式________________。
(5)电解完成后,a室的pH________(填“变大”、“变小”或“几乎不变”);b室发生反应的离子方程式为________________________。
【答案】-164.0 降低温度、增大压强 催化剂 b 4 100 2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O 几乎不变 H++HCO3-=CO2↑+H2O
【解析】
Ⅰ(1)根据盖斯定律解答;
(2)该主反应为气体分子数减小的放热反应,根据外界条件平衡移动的影响分析如何提高产率;
(3)结合图像曲线分析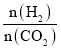 的比值,确定转化率,再利用“三段式”求解平衡常数;
的比值,确定转化率,再利用“三段式”求解平衡常数;
Ⅱ(4)由图2可知,HCO3-为反应物,CaCO3、CO2为生成物,据此分析书写离子反应方程式;
(5)a室为阳极室,阳极上发生氧化反应,电极反应式为2H2O-4e-=O2↑+4H+,阳离子向阴极移动,据此分析。
Ⅰ(1)由H2和CH4的燃烧热分别为285.5 kJ·mol-1和890.0 kJ·mol-1,可得:
①CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1
②H2(g)+![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.0 kJ·mol-1
④H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
根据盖斯定律知,①=②×4-③+④×2,则ΔH1=(-285.5 kJ·mol-1)×4-(-890.0 kJ·mol-1)+(+44 kJ·mol-1)×2=-164.0 kJ·mol-1;
(2)该主反应为气体分子数减小的放热反应,故有利于提高CH4产率的反应条件是降低温度、增大压强。催化剂具有专一性,工业上提高甲烷反应选择性的关键因素是催化剂;
(3)随着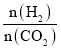 增大,H2的平衡转化率减小,CO2的平衡转化率增大,结合题图1可得,b表示H2的平衡转化率,a表示CO2的平衡转化率。c表示甲烷的体积分数,当
增大,H2的平衡转化率减小,CO2的平衡转化率增大,结合题图1可得,b表示H2的平衡转化率,a表示CO2的平衡转化率。c表示甲烷的体积分数,当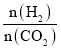 =4时,甲烷产率最高。
=4时,甲烷产率最高。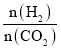 =4时,CO的产率趋于0,由题意并结合题图1得起始时c(CO2)=0.5 mol·L-1,c(H2)=2 mol·L-1,CO2、H2的平衡转化率均为0.80,则根据三段式法有:
=4时,CO的产率趋于0,由题意并结合题图1得起始时c(CO2)=0.5 mol·L-1,c(H2)=2 mol·L-1,CO2、H2的平衡转化率均为0.80,则根据三段式法有:
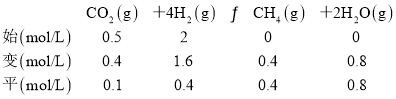
平衡常数K=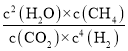 =
=![]() =100;
=100;
Ⅱ(4)由题图2可知,HCO![]() 为反应物,CaCO3、CO2为生成物,则钙化作用的离子方程式为2HCO
为反应物,CaCO3、CO2为生成物,则钙化作用的离子方程式为2HCO![]() +Ca2+=CaCO3↓+CO2↑+H2O;
+Ca2+=CaCO3↓+CO2↑+H2O;
(5)a室为阳极室,阳极上发生氧化反应,电极反应式为2H2O-4e-=O2↑+4H+,反应产生的H+通过质子交换膜进入b室参与反应生成CO2和H2O时进入阴极室与OH-也反应,所以电解后a室溶液的pH几乎不变,b室发生反应的离子方程式为H++HCO3-=CO2↑+H2O。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案