题目内容
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子的轨道表示式是 ________ 。
,其外围电子的轨道表示式是 ________ 。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是 _______ ,在元素周期表中的位置是 _______ 。
(3)C元素基态原子的轨道表示式是下图中的 ____________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合 ____________ (填序号)。
①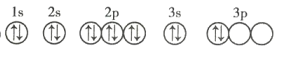
②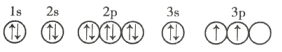
A 能量最低原则 B 泡利不相容原理 C 洪特规则
(4)元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能a叫作第一电离能(设为E)。第三周期元素的第一电离能示意图如图所示:
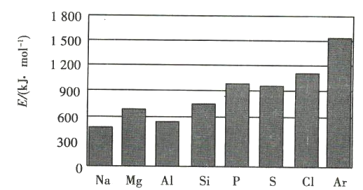
①同周期内,随着原子序数的增大,E值变化的总趋势是 ____________ ;
②根据图中提供的信息,可推断出E氧 ______ E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁 ____________ E钙。
【答案】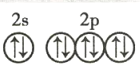 铬 第四周期第ⅥB族 ② C 增大 < >
铬 第四周期第ⅥB族 ② C 增大 < >
【解析】
(1)次外层电子数是最外层电子数的![]() 的元素是氖;
的元素是氖;
(2)1~36号元素中,原子核外电子排布中未成对电子数最多的元素是铬,共有6个未成对电子,在元素周期表中的位置是第四周期第ⅥB族;
(3)由该基态原子的轨道表示式中的电子数可知,C元素是硅,根据洪特规则,当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,故硅元素基态原子的轨道表示式为②,另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合洪特规则,故选C;
(4)①同周期内,随着原子序数的增大,第一电离能变化的总趋势是增大,E值变化的总趋势是增大;
②根据图中提供的信息,随着原子序数的增大,第一电离能变化的总趋势是增大,(处于半满、全满,能量较低),则E氧< E氟;
③同主族内,随着电子层数的增多,第一电离能变化的总趋势是减小,可推断出E镁>E钙。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案