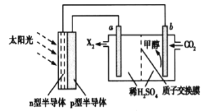
题目内容
【题目】常温下,Ka(HCOOH)=1.77×104,Ka(CH3COOH)=1.75×105,Kb(NH3·H2O) =1.75×105,下列说法正确的是
A. 相同体积pH均为3的HCOOH和CH3COOH溶液,中和NaOH的能力相同
B. 0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH 等体积混合后:c(HCOO) + c(OH) < c(HCOOH) + c(H+)
C. 浓度均为0.1 mol·L1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
D. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
【答案】C
【解析】
A.由电离平衡常数可知,HCOOH的酸性强于CH3COOH,pH均为3的HCOOH和CH3COOH溶液,CH3COOH的浓度大;B. 0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH 等体积混合后,溶液中的溶质为等物质的量浓度的HCOOH和HCOONa;C.电离平衡常数越大,其离子水解程度越小;D.升高温度,促进CH3COO的水解。
A.pH相同的HCOOH和CH3COOH溶液,物质的量浓度:c(HCOOH)<c(CH3COOH),则体积相同的两种溶液,HCOOH和CH3COOH的物质的量前者小于后者,所以后者消耗的NaOH更多,故A错误;
B. 0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH 等体积混合后,混合溶液中的溶质为等物质的量浓度的HCOOH和HCOONa,根据电荷守恒得c(HCOO)+c(OH)=c(Na+)+c(H+),因甲酸的电离程度大于甲酸根离子的水解程度,所以c(HCOOH)<c(Na+),则c(HCOO)+c(OH)>c(HCOOH)+c(H+),故B错误;
C.电离平衡常数越大,其对应离子的水解程度越小,根据电离平衡常数可知,离子水解程度: NH4+>HCOO,由电荷守恒得:c(HCOO)+c(OH)=c(Na+)+c(H+)=0.1mol/L+c(H+)、c(NH4+)+c(H+)=c(Cl)+c(OH)=0.1mol/L+c(OH),水解程度NH4+>HCOO,所以前者溶液中的c(H+)大于后者溶液中的c(OH),则浓度均为0.1molL1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者,故C正确;
D. CH3COO发生水解反应的离子方程式为CH3COO-+H2O![]() CH3COOH+OH-,水解平衡常数Kh=
CH3COOH+OH-,水解平衡常数Kh=![]() ,将CH3COONa溶液从20℃升温至30℃,促进CH3COO-的水解,水解平衡常数增大,即Kh=
,将CH3COONa溶液从20℃升温至30℃,促进CH3COO-的水解,水解平衡常数增大,即Kh=![]() 增大,所以
增大,所以![]() 减小,故D错误,答案选C。
减小,故D错误,答案选C。

【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05 g·cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
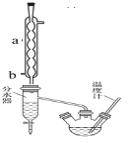
(1)制备粗产品:如图所示装置中,于50 mL圆底烧瓶中加入8.0 g苯甲酸(Mr=122)、20 mL乙醇(Mr=46,密度0.79 g·cm-3)、15 mL环己烷、3 mL浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2 h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
(2)粗产品纯化:加水30 mL,分批加入固体NaHCO3,分液,然后水层用20 mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213 ℃馏分。
相关数据如下:
沸点(℃,1 atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环己烷—水—乙醇) |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式______________________________________,仪器a的名称______________,b口为冷凝水的_____________(填“进水口”或“出水口”)。
(2)请说出在本实验中可以采取的能提高苯甲酸乙酯产率的方法_________________(写出任意一种即可)。
(3)如何利用实验现象判断反应已基本完成______________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3时的实验操作所用到的主要玻璃仪器为____________________。
(5)经精馏得210~213℃馏分7.0 mL,则实验中苯甲酸乙酯的产率为__________。