��Ŀ����
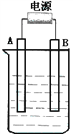
����Ŀ������ͼ��ʯī���缫�ĵ����У�����500mL��һ�����ʵ�ij��ɫ��Һ���е�⣬�۲쵽A�缫�����к�ɫ�Ĺ�̬�������ɣ�B�缫����ɫ�������ɡ���ش��������⣺
��1����д��B��������Ƽ���Ӧʽ��_________ ___________________ ��
��2��д�����ʱ��Ӧ�������ӷ���ʽ__________________________________________ ��
��3��������Һ�е�ԭ��������ȫ����ֹͣ��⣬ȡ��A�缫��ϴ�ӡ�����������缫����1.6g��������Һ��pHΪ____________ ��Ҫʹ������Һ�ָ������ǰ��״̬���������__________ ��������Ϊ______________g����������ǰ����Һ��������䣩
��4����ԭ��ҺΪ1L K2SO4��CuSO4�Ļ����Һ����c��SO42-��= 2.0mol/L����ͼװ�õ�⣬���������ռ���22.4L���壨��״����ʱ��ֹͣ��⡣��ԭ��Һ�е�c(K+)Ϊ _______
���𰸡� ���� 4OH--4e-=2H2O+O2�� 2Cu2++2H2O![]() 2Cu+O2��+4H+ 1 CuO 2 2mol/L
2Cu+O2��+4H+ 1 CuO 2 2mol/L
����������ɫ��Һ˵������ͭ���ӣ���ʯī���缫���ͭ����Һʱ��A�缫�����ɵĺ�ɫ��̬����ӦΪͭ����������AΪ��������BΪ����������������ɫ�������ɣ�˵��B�缫�����������ӷŵ磬�����ҺΪͭ�ĺ���������Һ��
��1��BΪ����������������ʧ���ӷ���������Ӧ�����������缫��ӦʽΪ��4OH--4e-=2H2O+O2����
��2�����ʱ��������ͭ���ӷŵ硢������ˮ�����������ӷŵ磬���Ե��ʱ��Ӧ�������ӷ���ʽΪ��2Cu2++2H2O![]() 2Cu+O2��+4H+��
2Cu+O2��+4H+��
��3��AΪ������������ԭ��Ӧ��A�缫����1.6gΪ����Cu�����������ʵ���Ϊ��1.6g��64g/mol=0.025mol�����ݵ�ط�Ӧ2Cu2++2H2O![]() 2Cu+O2��+4H+�ɵã�����H+�����ʵ���Ϊ��0.05mol����c(H+)=0.05mol��0.5L=0.1mol/L������pH=-lgc(H+)=1����������O2����������Cu������ԭ���غ㣬Cuԭ�Ӻ�Oԭ�Ӽ��ٵı���Ϊ1��1������Ҫʹ������Һ�ָ������ǰ��״̬���ɼ���CuO������Cuԭ���غ��n(CuO)=n(Cu)=0.025mol����m(CuO)=0.025mol��80g/mol=2g��
2Cu+O2��+4H+�ɵã�����H+�����ʵ���Ϊ��0.05mol����c(H+)=0.05mol��0.5L=0.1mol/L������pH=-lgc(H+)=1����������O2����������Cu������ԭ���غ㣬Cuԭ�Ӻ�Oԭ�Ӽ��ٵı���Ϊ1��1������Ҫʹ������Һ�ָ������ǰ��״̬���ɼ���CuO������Cuԭ���غ��n(CuO)=n(Cu)=0.025mol����m(CuO)=0.025mol��80g/mol=2g��
��4�����Ե缫���1LK2SO4��CuSO4�Ļ����Һ���������ռ�����״��22.4L���壨��������1mol����������������������Ӧ��4OH--4e-=2H2O+O2��������������Ӧ��Cu2++2e-=Cu��2H++2e-=H2�������ݵ�ʧ�����غ���n(H2)��2+n(Cu)��2=n(O2)��4����1mol��2+n(Cu)��2=1mol��4�����n(Cu)=1mol�����ݵ���غ�ɵ���n(K+)=2n(SO42-)-2n(Cu2+)=2��2.0mol/L��1L-2��1mol=2mol������c(K+)=2mol��1L=2mol/L��

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�