题目内容
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
【答案】 C4H8 CH2=CHCH2CH3、CH3CH=CHCH3、![]() 2 4
2 4
【解析】(1). 已知烃的相对分子质量为56,可以用商余法判断分子式,56÷14=4,正好除尽,所以该烃可能为烯烃或环烷烃,分子式为C4H8,故答案为:C4H8;
(2). 能使酸性高锰酸钾溶液褪色,应为烯烃,则可能的结构简式为:CH2=CHCH2CH3、CH3CH=CHCH3、![]() ,故答案为:CH2=CHCH2CH3、CH3CH=CHCH3、
,故答案为:CH2=CHCH2CH3、CH3CH=CHCH3、![]() ;
;
(3). 加成反应的特点是双键中一个键断开,其他原子或原子团加在不饱和碳上,原来的碳骨架不变,所以CH2=CHCH2CH3和CH3CH=CHCH3与氢气发生加成反应都得到正丁烷,![]() 与氢气发生加成反应得到异丁烷,故答案为:2;
与氢气发生加成反应得到异丁烷,故答案为:2;
(4). CH2=CHCH2CH3和溴化氢加成可得到1-溴丁烷和2-溴丁烷,CH3CH=CHCH3和溴化氢加成得到2-溴丁烷,![]() 和溴化氢加成可得到2-甲基-1-溴丙烷和2-甲基-2-溴丙烷,共4种,故答案为4。
和溴化氢加成可得到2-甲基-1-溴丙烷和2-甲基-2-溴丙烷,共4种,故答案为4。

 开心蛙口算题卡系列答案
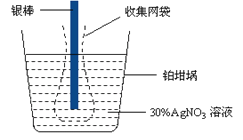
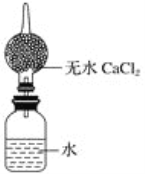
开心蛙口算题卡系列答案【题目】Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8℃熔点-116℃。实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下(图Ⅰ):

回答下列问题:
(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2。请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注。_______
(2)B中试剂a应选用______(填下列序号字母)。
a.CCl4 b.饱和NaCl溶液 c.浓H2SO4 d.饱和NaHCO3溶液
(3)通入适量的氯气,在C中生成棕黄色的物质Cl2O,该物质常温下为气体,方程式为:________
Cl2+ Na2CO3+ == NaHCO3+ NaCl+ Cl2O
(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置。
实验步骤 | 现象和结论 |
步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中。 | |
步骤二:向a试管中滴加BaCl2溶液,静置。 | 无明显现象,证明固体中不含Na2CO3 |
步骤三:_______________ | _______________ |
步骤四:_______________ | _______________ 则证明固体中含有NaCl。 |
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢