题目内容
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化: CH4(g)+1/2O2(g) ![]() CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
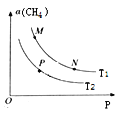
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_____________。
②M、N两点的H2的物质的量浓度c(M)____c(N)(填“>”“<”或“=”)。
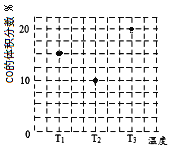
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) ![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
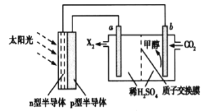
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为_________。
【答案】高温+247.1>反应①为放热反应,温度升高,平衡逆向移动,CH4(g)的平衡转化率降低,所以T1<T2,故P点平衡常数小于N点<T39V2/2a2 CO2+6e﹣+6H+=CH3OH+H2O
【解析】
(1).反应自发进行的条件是△H-T△S<0,水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ② 、CO(g)+H2O(g)
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ② 、CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3= -41.2kJ·mol-1 ③ ,根据盖斯定律②-③得二氧化碳重整的热化学方程式;
CO2(g)+H2(g) ΔH3= -41.2kJ·mol-1 ③ ,根据盖斯定律②-③得二氧化碳重整的热化学方程式;
(2). 反应①为气体体积增大的放热反应,根据平衡移动原理分析即可;
(3). 由图象分析可知随反应进行CO体积分数应是降低,达到平衡状态后升温平衡逆向进行;
(4). 由生成甲醇的光能储存装置可知,b电极上CO2得到电子生成甲醇。
(1). 反应自发进行的条件是△H-T△S<0,由水蒸气重整的热化学方程式CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1可知,该反应的△H>0、△S>0,要满足△H-T△S<0,则需要高温的条件,水蒸气重整:CH4(g)+H2O(g)
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1可知,该反应的△H>0、△S>0,要满足△H-T△S<0,则需要高温的条件,水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ② 、CO(g)+H2O(g)
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ② 、CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③ ,根据盖斯定律②-③得二氧化碳重整的热化学方程式为:CH4(g)+CO2(g)
CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③ ,根据盖斯定律②-③得二氧化碳重整的热化学方程式为:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH4=+247.1 kJ·mol-1,故答案为:高温;+247.1;
2CO(g)+2H2(g) ΔH4=+247.1 kJ·mol-1,故答案为:高温;+247.1;
(2). ①.反应①为放热反应,升高温度,甲烷的转化率降低,即T2>T1,化学平衡常数只受温度的影响,因此根据化学平衡常数的定义可知:K(N)>K(P),故答案为:>;反应①为放热反应,温度升高,平衡逆向移动,CH4(g)的平衡转化率降低,所以T1<T2,故P点平衡常数小于N点;
②.N点压强大于M点,对应反应①,增大压强平衡虽然向逆反应方向进行,但平衡移动的趋势微弱,组分的浓度依然增大,即氢气浓度c(M)<c(N),故答案为:<;
(3).随着反应的进行,CO的体积分数应该是降低的,达到平衡状态后升温平衡逆向进行,T1到T2温度升高一氧化碳体积分数减小,说明反应未达到平衡状态,反应正向进行,但T2不知是否为最低点,无法确定是否为平衡点,升温平衡逆向进行,一氧化碳体积分数增大,说明T3一定是平衡状态,由平衡三段式法得:
CO(g) +2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) a 2a 0
转化(mol) x 2x x
平衡(mol) a-x 2a-2x x,结合图象可知,![]() ×100%=20%,解得x=
×100%=20%,解得x=![]() ,根据平衡常数表达式K=
,根据平衡常数表达式K=![]() ,代入数值得K=9V2/2a2,故答案为T3;9V2/2a2;
,代入数值得K=9V2/2a2,故答案为T3;9V2/2a2;
(4).由装置图可知,在b电极上CO2得到电子生成甲醇,且此装置的电解质溶液为稀硫酸,所以b电极反应式为CO2+6e﹣+6H+=CH3OH+H2O,故答案为:CO2+6e﹣+6H+=CH3OH+H2O。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案【题目】碳元素与人们的日常生活、生活和科学研究密不可分。请回答下列问题。
(1)乙烯具有水果催熟的功效,乙烯的电子式是______________。
(2)Al2O3真空碳热还原一氯化法是一种新的炼铝工艺,该法流程短,设备简单,符合目前国家提倡节能减排、改造升级的大环境。
①其中冶炼过程中发生的反应有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
则Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代数式表示)。
②Al4C3是真空碳热还原一氯化法炼铝的中间产物,该物质与水反应生成最简单的有机物。该反应的化学方程式为__________________________________。
(3)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20min内的平均反应速率v(CO2)=_______mol·L-1·min-1;第一次达到平衡的平衡常数K=__________。
②30min时只改变某一条件,则改变的条件可能是______________ (填字母编号)。
a.升高温度 b.降低温度 c.再通入一定量的NO
d.缩小容器的体积 e.加入合适的催化剂 f.增大容器休积
(4)炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g)![]() 2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
2CO(g)△H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:

①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:气体分压P分=P总×气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的
,在不同的温度下该反应的
平衡常数如表所示
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述正确的是( )
A. 该反应的化学方程式是: H2(g)+CO2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
B. 上述反应的正反应是吸热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,如果此时测得CO2为0.5 mol,则该反应达到平衡状态
D. 某温度下,如果平衡常数符合下列关系式: ![]() =
=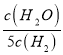 ,则此时温度700℃
,则此时温度700℃