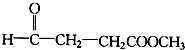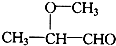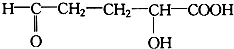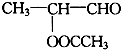题目内容
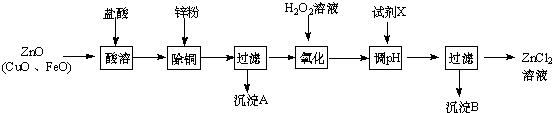
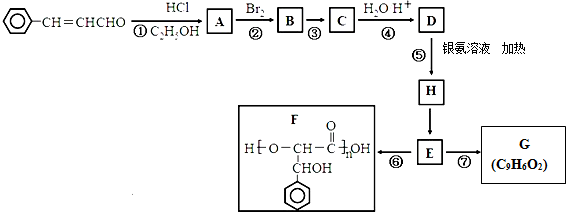
2.以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO为原料,可以制取氧化锌和金属锌)Ⅰ、制取氯化锌主要工艺如图:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
(2)流程图中,为了降低溶液的酸度,试剂X不可以是d(选填序号);pH应调整到3.2≤pH<5.2
a.ZnO b.Zn(OH)2 c.Zn2(OH)2CO3 d.ZnSO4
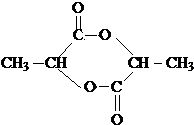
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
 ,聚乳酸的结构简式为
,聚乳酸的结构简式为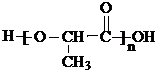 .
.Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq)},然后电解浸取液.
(4)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-;.
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
分析 炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,沉淀A为Cu,滤液中含有锌离子和亚铁离子,加入过氧化氢把亚铁离子氧化为铁离子,再加ZnO(或氢氧化锌等)调节pH,使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液.(1)加过氧化氢把亚铁离子氧化为铁离子;
(2)调节pH时要消耗氢离子,但是不能引入杂质;调节pH使铁离子转化为沉淀,而锌离子不沉淀,根据表中数据分析;
(3)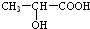 分子中含有-COOH和-OH,结合丙交酯的分子式可知,两分子的乳酸分子间发生酯化反应脱去两分子水生成丙交酯;
分子中含有-COOH和-OH,结合丙交酯的分子式可知,两分子的乳酸分子间发生酯化反应脱去两分子水生成丙交酯;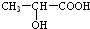 分子间发生缩聚反应生成聚乳酸和水;
分子间发生缩聚反应生成聚乳酸和水;
(4)石墨作电极电解时,阳极氢氧根离子失电子生成氧气与水,阴极上[Zn(OH)4]2-得电子生成Zn与氢氧根离子;
(5)ZnO能溶液强碱溶液,CuO和FeO不溶于碱溶液.
解答 解:炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,沉淀A为Cu,滤液中含有锌离子和亚铁离子,加入过氧化氢把亚铁离子氧化为铁离子,再加ZnO(或氢氧化锌等)调节pH,使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液.
(1)加过氧化氢亚铁离子氧化为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)调节pH时要消耗氢离子,但是不能引入杂质,ZnO、Zn(OH)2、Zn2(OH)2CO3均与氢离子反应生成锌离子,消耗氢离子的同时不引人杂质,ZnSO4不能与氢离子反应,所以不能调节pH;
调节pH使铁离子转化为沉淀,而锌离子不沉淀,由表中数据可知pH≥3.2时,铁离子完全沉淀,而锌离子开始沉淀的pH为5.2,所以要调节pH为3.2≤pH<5.2;
故答案为:d;3.2≤pH<5.2;
(3)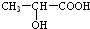 分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为
分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为 ;
;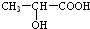 分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为:
分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为: ;
;
故答案为: ;
; ;
;
(4)石墨作电极电解时,阳极氢氧根离子失电子生成氧气与水阳极反应为:4OH--4e-═2H2O+O2↑,
阴极上[Zn(OH)4]2-得电子生成Zn与氢氧根离子,则阴极的电极方程式为:[Zn(OH)4]2-+2e-=Zn+4OH-故答案为:O2;[Zn(OH)4]2-+2e-=Zn+4OH-;
(5)ZnO能溶液强碱溶液,CuO和FeO不溶于碱溶液,酸溶液与ZnO、CuO、FeO均能反应,所以炼锌烟尘采用碱溶,而不采用酸溶后电解,
故答案为:氧化铜、氧化亚铁不溶于碱溶液中.
点评 本题考查物质的制备工艺流程,涉及对工艺流程的分析评价、物质的分离提纯、酯化反应和缩聚反应、电解原理的应用等知识点,是对学生综合能力考查,需要学生具备扎实的基础,题目难度中等.

 向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )
向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )| A. | 水的电离程度一直增大 | |
| B. | 溶液的pH逐渐下降 | |
| C. | M、N两点对应的溶液中离子种类不同 | |
| D. | CD段反应的离子方程式为OH-+CO2=HCO3- |
| A. | 甲苯的硝化、油脂的皂化均可看作取代反应 | |
| B. | 蛋白质水解生成葡萄糖放出热量,提供生命活动的能量 | |
| C. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| D. | 棉花和合成纤维的主要成分是纤维素 |
| A. | MgCl2 | B. | H2O | C. | K2O2 | D. | NaOH |
| A. | 向盐酸中滴加氨水:H++OH-=H2O | |
| B. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| D. | Na2SO3溶液中加入稀硝酸:SO32-+2H+=SO2↑+H2O |
4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )
| A. | 0.04 mol/(L•s) | B. | 0.06 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
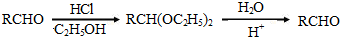
 .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$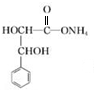 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. .(任写一种)
.(任写一种)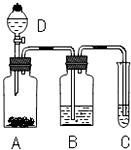 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题: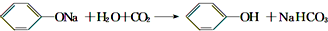 .
.