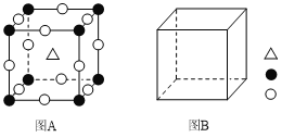
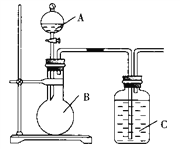
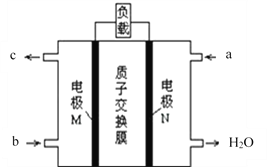
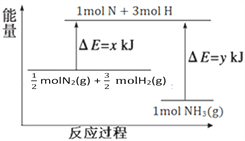
题目内容
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
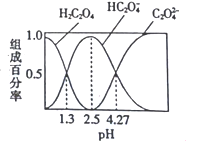
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
【答案】A
【解析】A. 由图可知,pH=4.27 的溶液中c(HC2O4-)=c(C2O42-),此时的溶液中没有H2C2O4,根据电荷守恒得:c(K+)+c(H+)=c(OH)+c(HC2O4)+2c(C2O42),由于c(HC2O4-)=c(C2O42-),则c(K+)+c(H+)=c(OH)+3c(C2O42),故A正确;B. 根据图象分析可知,pH=1.3时,c(H2C2O4)=c(HC2O4-),草酸的一级电离常数为K1=[(HC2O4-)×c(H+)]/c(H2C2O4),则K1=101.3,pH=4.27时,c(HC2O4-)=c(C2O42-),草酸的二级电离常数为K2=[c(C2O42-)×c(H+)]/c(HC2O4-),则K2=104.27,反应HC2O4-+H2O![]() H2C2O4+OH-是HC2O4-的水解反应,平衡常数K=[c(OH)c(H2C2O4)]/c(HC2O4-)=Kw/K1=1012.70,故B错误;C. 向溶液中加KOH溶液,pH由1.3增大至4.27的过程中,溶液始终是酸性的,水的电离受到抑制,随着pH的增大,溶液中酸电离出的H+越来越少,对水的抑制作用不断减弱,水的电离程度不断增大,故C错误;D. 由图可知,pH=2.5时,溶液中不含有H2C2O4和C2O42-,故D错误;答案选A。
H2C2O4+OH-是HC2O4-的水解反应,平衡常数K=[c(OH)c(H2C2O4)]/c(HC2O4-)=Kw/K1=1012.70,故B错误;C. 向溶液中加KOH溶液,pH由1.3增大至4.27的过程中,溶液始终是酸性的,水的电离受到抑制,随着pH的增大,溶液中酸电离出的H+越来越少,对水的抑制作用不断减弱,水的电离程度不断增大,故C错误;D. 由图可知,pH=2.5时,溶液中不含有H2C2O4和C2O42-,故D错误;答案选A。

 中考解读考点精练系列答案
中考解读考点精练系列答案