题目内容
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
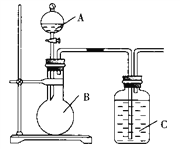
已知:高锰酸钾在常温下与浓盐酸反应产生氯气。
(1)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是___________________________
(2)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明硫的非金属性比氯的非金属性________(填“强”或“弱”或“无法判断”)。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂________________,实验现象为_________________________该装置存在不足之处,改进措施为:______________________________________
【答案】 淀粉-KI溶液变蓝色 弱 硅酸钠溶液 有白色沉淀生成 在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶
【解析】(1)盐酸和高锰酸钾之间反应产生氯气,氯气将碘离子氧化为碘单质,碘单质遇到淀粉变蓝色,故答案为:淀粉-KI溶液变蓝色;
(2)装置C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,反应的化学方程式为:Cl2+H2S═S↓+2HCl;证明硫元素比氯元素非金属性弱,故答案为:弱;
(3)现有硝酸溶液、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明非金属性:N > C > Si,即需要证明酸性:HNO3>H2CO3>H2SiO3;因此先加入硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸沉淀;装置C中反应是:CO2+SiO32-+H2O =H2SiO3↓+CO32-,C中装试剂硅酸钠溶液;现象为有白色沉淀生成;但是浓硝酸具有挥发性,防止硝酸和硅酸钠之间反应的干扰,所以在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶,故答案为:硅酸钠溶液;有白色沉淀生成;在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶。

【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.该反应可表示为X+3Y2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 molL﹣1min﹣1
D.增大压强使平衡向生成Z的方向移动