题目内容
【题目】铬、钛及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价层电子的轨道表达式(电子排布图)为_________________________。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为_________,中心碳原子的杂化类型为_________;Cr[OC(NH2)2]6Cl3含有的化学键类型有__________________。
(3)氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1282℃)比氯化钠的高,主要原因是_________________________________________。
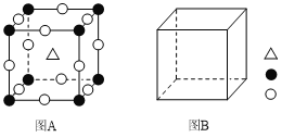
(4)钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于_________位置,O处于_________位置;与Ca紧邻的O个数为_________,Ti与O间的最短距离为____________________nm 。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;![]() ,
,![]() ,
,![]() 所代表的原子种类与图A相同)____________________。
所代表的原子种类与图A相同)____________________。
【答案】 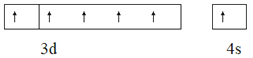 O>N>C>H sp2 配位键、共价键、离子键 氮化铬的离子电荷数较多,晶格能较大 体心 棱心 6
O>N>C>H sp2 配位键、共价键、离子键 氮化铬的离子电荷数较多,晶格能较大 体心 棱心 6 ![]()
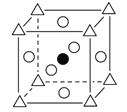
【解析】(1)24号元素是铬,其价层电子排布式为3d54s1,则轨道表达式为:![]() ;(2)(NH2)2CO中含有N、H、O、C,电负性由大到小的顺序为O>N>C>H,(NH2)2CO结构中碳原子上有二根单键、一个双键,则参加杂化轨道数为:(2+1)(1是双键中一个单键),杂化类型为sp2。(3)氮化铬的晶体与氯化钠晶体都是离子晶体,因为氮化铬的离子电荷数较多,晶格能较大,所以,氮化铬熔点比氯化钠的高。(4)①由晶胞图分析,黑球为1个,白球为12/4=3个,三角为1个,因TiO32—中钛与氧结合形成酸根离子,则三角所处位置为钛,即体心位置,氧位于立方体棱上;由三维立体对称分析,与Ca紧邻的O个数为6,Ti与O间的最短距离是面对角线的一半,即
;(2)(NH2)2CO中含有N、H、O、C,电负性由大到小的顺序为O>N>C>H,(NH2)2CO结构中碳原子上有二根单键、一个双键,则参加杂化轨道数为:(2+1)(1是双键中一个单键),杂化类型为sp2。(3)氮化铬的晶体与氯化钠晶体都是离子晶体,因为氮化铬的离子电荷数较多,晶格能较大,所以,氮化铬熔点比氯化钠的高。(4)①由晶胞图分析,黑球为1个,白球为12/4=3个,三角为1个,因TiO32—中钛与氧结合形成酸根离子,则三角所处位置为钛,即体心位置,氧位于立方体棱上;由三维立体对称分析,与Ca紧邻的O个数为6,Ti与O间的最短距离是面对角线的一半,即![]() nm。②不论如何画图,原子个数比不变,原子配位数不变,故新的结构图:
nm。②不论如何画图,原子个数比不变,原子配位数不变,故新的结构图: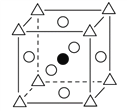 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.该反应可表示为X+3Y2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 molL﹣1min﹣1
D.增大压强使平衡向生成Z的方向移动